
|
学习小专题 |
 怎样用活化分子和活化能的概念理解浓度、温度等外界条件对反应速
日期:2017-04-25 16:41:02
点击:12777
好评:0
怎样用活化分子和活化能的概念理解浓度、温度等外界条件对反应速
日期:2017-04-25 16:41:02
点击:12777
好评:0
化学反应产生的先决条件,是反应物分子之间必须相互接触,然后才能互相作用,否则就不可能引起反应。不过反应物分子之间,并不是每一次碰撞都能产生反应的。以气体间的反应来说,我们知道,气体分子是以极大的速率向各个方向运动着,分子之间不断地相互碰撞,倘若每一次...
 化学反应速率的影响因素及其解释
日期:2017-04-25 16:29:20
点击:39489
好评:2
化学反应速率的影响因素及其解释
日期:2017-04-25 16:29:20
点击:39489
好评:2
一、化学反应速率的影响因素 主要决定化学反应速率的因素是反应物的性质。影响因素有:浓度、压强、温度、催化剂、表面积、光、超声波、原电池与电解池。 1 、浓度: ① 结论:增加浓度,就加快反应的速率;降低浓度就,减慢反应速率。对于可逆反应,既增 加正反应速率...
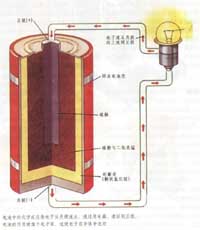 动画演示:从有效碰撞机率解析化学反应速率
日期:2016-04-18 23:01:50
点击:760
好评:0
动画演示:从有效碰撞机率解析化学反应速率
日期:2016-04-18 23:01:50
点击:760
好评:0
...
 动画演示:各种条件下有效碰撞
日期:2016-04-18 23:01:05
点击:898
好评:1
动画演示:各种条件下有效碰撞
日期:2016-04-18 23:01:05
点击:898
好评:1
...
 动画演示:有效碰撞
日期:2016-04-18 23:00:42
点击:1141
好评:0
动画演示:有效碰撞
日期:2016-04-18 23:00:42
点击:1141
好评:0
...
 活化分子有效碰撞问题的探析
日期:2016-03-24 17:41:23
点击:2450
好评:1
活化分子有效碰撞问题的探析
日期:2016-03-24 17:41:23
点击:2450
好评:1
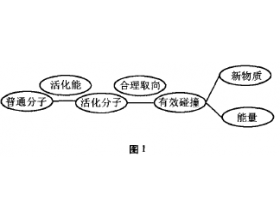
一个化学反应一般经历的过程可用图1表 上述流程揭示:在反应物分子(普通分子)获 得了一定能量后变成活化分子的基础上,必须在 合适的方向上进行碰撞才能构成有效碰撞,从而形成化学反应,生成新物质同时伴随能量的发生, 可见活化分子的碰撞是有效碰撞的必要条件,形 成活化...
 化学反应的活化能
日期:2016-02-01 12:13:27
点击:12407
好评:-2
化学反应的活化能
日期:2016-02-01 12:13:27
点击:12407
好评:-2
实验证明,只有发生碰撞的分子的能量等于或超过某一定的能量Ec(可称为临界能)时,才可能发生有效碰撞。具有能量大于或等于Ec的分子称为活化分子。 在一定温度下,将具有一定能量的分子百分数对分子能量作图,如图1所示。从图1可以看出,原则上来说,反应物分子的能量可...
 为什么说活化能越小,活化分子越多,分子间的碰撞越有效?
日期:2015-02-01 17:27:29
点击:4030
好评:1
为什么说活化能越小,活化分子越多,分子间的碰撞越有效?
日期:2015-02-01 17:27:29
点击:4030
好评:1
(1)分子间要发生反应,必须进行碰撞。但并不是所有的碰撞都可以发生反应,这是可以理解的,所以把会发生反应的那部分碰撞,称为有效碰撞。有效碰撞的条件之一是两个碰撞的分子都具有足够的能量。我们就将这些具有足够能量的分子称为活化分子了。所以说,为什么不是全部碰撞...
 动画演示:有效碰撞的几种形式
日期:2012-11-27 18:31:24
点击:548
好评:2
动画演示:有效碰撞的几种形式
日期:2012-11-27 18:31:24
点击:548
好评:2
...
 课件学习:有效碰撞理论简介
日期:2012-04-24 22:07:38
点击:573
好评:0
课件学习:有效碰撞理论简介
日期:2012-04-24 22:07:38
点击:573
好评:0
...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。