
|
学习小专题 |
 浅谈用“ΔG =ΔH-TΔS”对反应产物的分析
日期:2023-02-26 17:59:35
点击:12522
好评:0
浅谈用“ΔG =ΔH-TΔS”对反应产物的分析
日期:2023-02-26 17:59:35
点击:12522
好评:0
1 、焦炭在高温下与水蒸气的反应。本反应的主要产物是 CO 和 H 2 ,并非 CO 2 和 H 2 。由于化学反应 C(s)+H 2 O(g)=CO(g)+H 2 (g) 的Δ H y = ﹢ 132kJ/mol 、Δ G y = ﹢ 91kJ/mol 、Δ S y = ﹢ 133J/(K · mol) ,由Δ G y = ﹢ 91kJ/mol > 0 可知反应不能自发正向...
 化学反应的进行的方向和和化学反应的自发性
日期:2017-10-26 09:51:53
点击:9682
好评:0
化学反应的进行的方向和和化学反应的自发性
日期:2017-10-26 09:51:53
点击:9682
好评:0
一、化学反应进行的方向判定方法 1 、通过正逆反应速率的比较 当 V 正 V 逆 时,平衡朝正反应方向移动。 当 V 正 =V 逆 时,平衡不移动。或反应处在平衡状态。 当 V 正 V 逆 时,平衡朝逆反应方向移动。 2 、可以通过平衡常数 K 的改变判断: 当升高温度, K 值增大,意...
 略谈化学反应进行方向的几个理解误区
日期:2017-10-26 09:45:28
点击:1667
好评:0
略谈化学反应进行方向的几个理解误区
日期:2017-10-26 09:45:28
点击:1667
好评:0
化学反应进行的方向是新课程人教版化学教材在选修模 块中新增加的知识,《普通高中化学课程标准》只要求学生“能 用焓变和熵变说明化学反应进行的方向”,在《2012年高考全 国新课标(化学)考试大纲》中也没有专门要求,但它对于学习 原电池的形成条件、化学反应发生的条...
 《化学反应方向--增熵和减能》实录
日期:2016-05-16 22:38:17
点击:4061
好评:0
《化学反应方向--增熵和减能》实录
日期:2016-05-16 22:38:17
点击:4061
好评:0
一、自发变化的基本趋势 这个教室里充满了空气,看不见摸不着,但是它客观存在。研究表明,这些气体的分子无时无刻不在做杂乱无章的、高速的运动。而且据说是折线形,为什么,到处是分子,要碰撞。常温常压下,这些气体分子的平均速度可以达到甚至超过500米/秒,如果允...
 浅谈熵焓在中学化学中的应用
日期:2016-05-16 22:22:35
点击:2197
好评:0
浅谈熵焓在中学化学中的应用
日期:2016-05-16 22:22:35
点击:2197
好评:0
在新课程化学反应原理模块中增加了熵、焓、化学反应的方 向、化学平衡常数等知识。其优点是拓展了学生的知识面,使整个 知识系统完整,同时加深了学生对化学平衡,化学反应进行方向, 化学平衡进行的程度以及转化率深刻的理解。其不足是造成了教 师教学上的困难与学生学习上的...
 判断氧化还原反应方向的一般规律
日期:2016-03-27 11:05:20
点击:1361
好评:0
判断氧化还原反应方向的一般规律
日期:2016-03-27 11:05:20
点击:1361
好评:0
...
 关于化学反应进行的方向和限度的理解
日期:2016-02-01 12:02:17
点击:6214
好评:0
关于化学反应进行的方向和限度的理解
日期:2016-02-01 12:02:17
点击:6214
好评:0
此内容属于《物理化学》中的化学热力学的范畴,课本中仅给予简单的引导式的介绍,是为了激发学生的兴趣,不需要深究。也就是说,对于焓判据、熵判据、自由能判据都不需要也不可能真正地理解。 什么叫方向、限度、判据?举一个容易理解的例子说明。比如有一块800℃的红热...
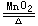 熵判据的知识分析
日期:2016-02-01 11:09:16
点击:2846
好评:0
熵判据的知识分析
日期:2016-02-01 11:09:16
点击:2846
好评:0
在日常教学中发现学生对于熵判据的理解比较困难,在课后的作业完成中也有部分学生对熵判据考查的题目无从下手。首先我们需要明确单独使用熵判据对化学反应方向进行独立判断是片面的,有了这个前提,我们在这个知识点的要求上,只需要了解基本的熵变判断和熵变决定化学反...
 熵判据
日期:2016-01-31 20:50:58
点击:34566
好评:2
熵判据
日期:2016-01-31 20:50:58
点击:34566
好评:2
一、熵、熵增原理、熵判据 1、熵(混乱度):在密闭条件下,体系有由有序自发地转变为无序的倾向,这种推动体系变化的因素称作熵。 2、熵判据:在与外界隔离的体系中,自发过程将导致体系的熵增大,这一经验规律叫做熵增原理。是在用来判断化学反应方向时就称为熵判据。...
 也谈新课标中焓熵学习的深广度
日期:2014-06-30 19:39:22
点击:8141
好评:30
也谈新课标中焓熵学习的深广度
日期:2014-06-30 19:39:22
点击:8141
好评:30
化学反应原理模块是选修模块中唯一一个必考模块,主要内容包括三部分:化学反应与能量变化、反应速率与化学平衡、溶液中的离子平衡。 化学反应原理每个部分都按照“认识化学反应”到“应用化学反应”的认识线索展开。并且,这里的每个部分都有新增内容,反应与能量变化...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。