
|
学习小专题 |

|
学习小专题 |
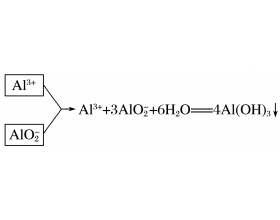 [注解与辨疑6] 氢氧化铝的三种制备方法 作者:化学自习室 来源:未知 日期:2019-12-25 09:39:49 点击:15805 所属专题:氢氧化铝
[注解与辨疑6] 氢氧化铝的三种制备方法 作者:化学自习室 来源:未知 日期:2019-12-25 09:39:49 点击:15805 所属专题:氢氧化铝
一、知识梳理 方法一:可溶性铝盐溶液与过量氨水反应 反应原理: Al 3 + + 3NH 3 ·H 2 O == =Al(OH) 3 ↓ + 3NH4+ 方法二:向可溶性偏铝酸盐溶液中通入过量 CO 2 反应原理: AlO2- + 2H 2 O + CO 2 == =Al(OH) 3 ↓ + HCO3- 方法三:相互促进水解法 二、应用与训练...
 [注解与辨疑6] 铁及其化合物是非判断 作者:化学自习室 来源:未知 日期:2019-11-14 19:40:48 点击:986 所属专题:铁及其化合物 是非判断
[注解与辨疑6] 铁及其化合物是非判断 作者:化学自习室 来源:未知 日期:2019-11-14 19:40:48 点击:986 所属专题:铁及其化合物 是非判断
一、正误判断 1.(2018·江苏)Cu与FeCl 3 溶液反应可生成CuCl 2 。( ) 2.(2015·广东)向FeSO 4 溶液中先滴入KSCN溶液再滴加H 2 O 2 溶液,加入H 2 O 2 后溶液变成血红色,说明Fe 2+ 既有氧化性又有还原性。( ) 3.(2015·全国卷Ⅰ)将稀硝酸加入过量铁粉中,充分反应后滴加...
 [注解与辨疑6] 镁铝化合物是非判断 作者:化学自习室 来源:未知 日期:2019-11-14 19:33:37 点击:1112 所属专题:铝及其化合物 是非判断
[注解与辨疑6] 镁铝化合物是非判断 作者:化学自习室 来源:未知 日期:2019-11-14 19:33:37 点击:1112 所属专题:铝及其化合物 是非判断
一、正误判断 1.(2017·全国卷Ⅱ)向2 mL 0.1 mol·L -1 的FeCl 3 溶液中加足量铁粉,振荡,加1滴KSCN溶液,现象为黄色逐渐消失,加KSCN溶液颜色不变,则还原性:Fe>Fe 2+ 。( ) 2.(2018·全国卷Ⅱ)向盛有2 mL 黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化...
 [注解与辨疑6] 铜及其化合物是非判断 作者:化学自习室 来源:未知 日期:2019-11-14 19:22:06 点击:583 所属专题:铜及其化合物 是非判断
[注解与辨疑6] 铜及其化合物是非判断 作者:化学自习室 来源:未知 日期:2019-11-14 19:22:06 点击:583 所属专题:铜及其化合物 是非判断
一、正误判断 1. (2017·全国卷Ⅲ)除去溶液中的Cl - ,可向溶液中同时加入Cu和CuSO 4 ,生成CuCl沉淀从而除去Cl - 。除Cl - 的反应为Cu+Cu 2+ +2Cl - ===2CuCl。( ) 2. 加热条件下氨可被CuO氧化成一种气体单质,该反应的化学方程式为3CuO+2NH 3 ==3Cu+N 2 +3H 2...
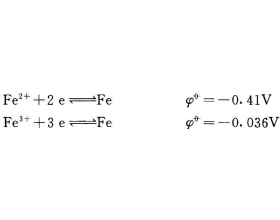 [注解与辨疑6] 如何理解Fe2+离子和Fe3+离子的稳定性及其相互转化? 作者:化学自习室 来源:未知 日期:2021-12-28 08:46:50 点击:3915 所属专题:铁三角
[注解与辨疑6] 如何理解Fe2+离子和Fe3+离子的稳定性及其相互转化? 作者:化学自习室 来源:未知 日期:2021-12-28 08:46:50 点击:3915 所属专题:铁三角
铁原子具有3d 6 4s 2 的价电子层结构,在化学反应中,铁原子 最外层上的4S电子首先失去,使铁呈+2价。由于半充满的D电 子层结构比较稳定,因此铁原子里6个3d电子中的1个电子也比较容易失去,于是铁也可呈现+ 3价。在一定条件下,铁还能呈+ 6价。 由上列电极电位可知...
 [注解与辨疑6] +1价铜与+2价铜相互转化关系分析 作者:化学自习室 来源:未知 日期:2019-11-13 08:42:35 点击:4339 所属专题:铜及其化合物
[注解与辨疑6] +1价铜与+2价铜相互转化关系分析 作者:化学自习室 来源:未知 日期:2019-11-13 08:42:35 点击:4339 所属专题:铜及其化合物
铜的外围电子构型是3d 10 4s 1 ,但具有变价。这是因为铜原子 中3d轨道上的电子和4s轨道上的电子,在能量上差别不大(相差 约1. 11. 4 KJ mol -1 ),故在通常条件下,铜不但可失去4s轨道 上1个电子,而且还可再失去3d轨道上的电子,因此具有可变化合价。铜有+1价、+2价和...
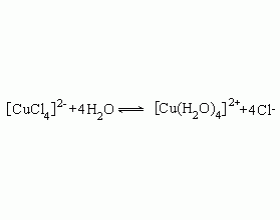 [注解与辨疑6] 为啥氯化铜溶液与硫酸铜溶液颜色不同? 作者:化学自习室 来源:未知 日期:2019-09-12 15:07:21 点击:3888 所属专题:氯化铜 硫酸铜
[注解与辨疑6] 为啥氯化铜溶液与硫酸铜溶液颜色不同? 作者:化学自习室 来源:未知 日期:2019-09-12 15:07:21 点击:3888 所属专题:氯化铜 硫酸铜
硫酸铜溶液显蓝色,氯化铜溶液为绿色。为什么同为铜盐,但颜色不同?如果仅仅用酸根离子不同作理由来解释,是不足以服人的。要透彻解释应该从 Cu 2+ 的络离子说起。 Cu 2+ 有配位数 2 、 4 、 6 的络离子。在胆矾 CuSO 4 · 5H 2 O 中,四个水分子以平行四边形配位在C...
 [元素化合物] 复习讲义:全面认识铜及其化合物 作者:淮畔化学 来源:未知 日期:2019-08-06 22:44:48 点击:3866 所属专题:铜及其化合物
[元素化合物] 复习讲义:全面认识铜及其化合物 作者:淮畔化学 来源:未知 日期:2019-08-06 22:44:48 点击:3866 所属专题:铜及其化合物
就高考备考中,尤其关于铜的知识给同学们列出以下复习提纲: 1、概括为三大部分: (1)铜的游离态——即铁单质 (2)铜的化合态——即铜的化合物(包括含铜元素的盐、碱、氧化物) (3)铜的冶炼(火法、湿法炼铜、电解精炼) 2、铜单质的五个方面: (1)铜原子结构、基态铜原子、Cu 2...
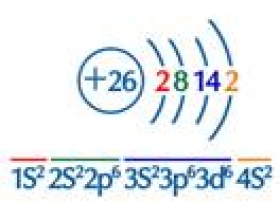 [元素化合物] 复习讲义:全面认识铁及其化合物 作者:淮畔化学 来源:未知 日期:2019-08-06 22:42:28 点击:3314 所属专题:铁及其化合物
[元素化合物] 复习讲义:全面认识铁及其化合物 作者:淮畔化学 来源:未知 日期:2019-08-06 22:42:28 点击:3314 所属专题:铁及其化合物
本次将给同学们复习整理铁及其化合物,由于涉及铁元素的多种价态物质,内容较为丰富。并且,价态间的物质变化涉及氧化还原反应,所以有关铁元素的物质间的相互转化也很重要。还有一点,氧化还原反应又与电化学紧密联系,包括铁的电化学腐蚀与防护,故同学们应当努力完成...
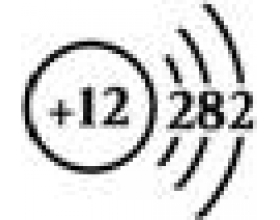 [元素化合物] 复习讲义:全面认识镁及碱土金属 作者:淮畔化学 来源:未知 日期:2019-08-06 21:50:41 点击:4608 所属专题:镁 碱土金属
[元素化合物] 复习讲义:全面认识镁及碱土金属 作者:淮畔化学 来源:未知 日期:2019-08-06 21:50:41 点击:4608 所属专题:镁 碱土金属
就高考备考中,尤其关于镁的知识给同学们列出以下复习提纲: 1、概括为三大部分:镁的游离态——即镁单质、镁的化合态——即镁的化合物(包括含镁元素的碱、盐、氧化物)和碱土金属的周期性变化及特殊性 2、镁单质的六个方面: (1)镁原子结构、基态镁原子(镁离子)价电子排布、...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、汞齐——汞是金属溶剂 1、汞齐,是一种汞与几种其他金属所形成的合金。“齐”通“...
Al(OH) 3 具有两性,当它作为弱酸时,脱去一个水分子,即为偏铝酸HAlO 2 ,其钠盐为偏...
课本中出现合金这个科普话题,认点真的学习者自然会想到两个很基本的问题。 1 ,合金...
Fe+nSCN[Fe(SCN)n](3n)+(n=16) 在水溶液中,Fe通常以六水合离子[Fe(H2O)6]形式存在,...
结构不同,一般认为不是同一种物质。 第一:二者结构的区别 ①铝酸 铝酸的化学式为 ,...
合金更完备的定义为:合金是由两种或多种元素组成的物质,其中至少有一种是金属。这些...
铝酸HAlO 铝酸HAlO通常指的就是氢氧化铝Al(OH),它是一种两性氢氧化物,既能与酸反应...
1.冰晶石是如何“助熔”氧化铝的? 氧化铝的熔点太高(2050℃),工业生产中较难获得并...