
|
学习小专题 |

|
学习小专题 |
 [方法与规律e] 原子杂化方式判断五法 作者:刘心宇 来源:未知 日期:2016-03-19 22:30:03 点击:3140 所属专题:杂化类型判断
[方法与规律e] 原子杂化方式判断五法 作者:刘心宇 来源:未知 日期:2016-03-19 22:30:03 点击:3140 所属专题:杂化类型判断
第二页 第三页...
 [方法与规律e] δ键和π键成键数目巧判断 作者:向小平 来源:未知 日期:2016-03-13 20:55:46 点击:8314 所属专题:δ键 π键
[方法与规律e] δ键和π键成键数目巧判断 作者:向小平 来源:未知 日期:2016-03-13 20:55:46 点击:8314 所属专题:δ键 π键
理论分析:共价键理论中,根据原子轨道最大重叠原理,成键时轨 道之间有两种不同的重叠方式,从而形成两种类型的共价键——δ键和 π键。δ键——以‘‘头碰头”方式进行重叠,轨道的重叠部分沿键轴呈 圆柱形对称分布,原子轨道间以重叠方式形成的共价键,π键——原子 ...
 [方法与规律e] 关于共价键的计算 作者:甑炳杨 来源:未知 日期:2016-03-17 09:22:45 点击:3445 所属专题:共价键
[方法与规律e] 关于共价键的计算 作者:甑炳杨 来源:未知 日期:2016-03-17 09:22:45 点击:3445 所属专题:共价键
在物质结构中,关于共价键的计算常常使学生感到棘手,不知所措。其实,共价键是由共用电子对产生的,故共价键的计算从成键电子对人手,就能较 深刻地理解和分析了。下面仅就几例加以分析。 例1 :C m H n 分子中共有多少共价键,其中C-C 键为多少个? 分析:在烃分子中C...
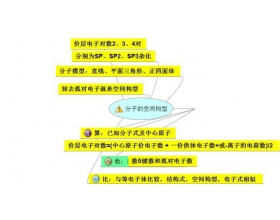 [方法与规律e] 分子的空间构型的确定方法图 作者:郑益强 来源:未知 日期:2016-01-30 12:30:26 点击:1284 所属专题:空间结构
[方法与规律e] 分子的空间构型的确定方法图 作者:郑益强 来源:未知 日期:2016-01-30 12:30:26 点击:1284 所属专题:空间结构
...
 [方法与规律e] 中心原子杂化类型的判断 作者:林飞 来源:未知 日期:2014-10-15 16:20:20 点击:11456 所属专题:杂化类型判断
[方法与规律e] 中心原子杂化类型的判断 作者:林飞 来源:未知 日期:2014-10-15 16:20:20 点击:11456 所属专题:杂化类型判断
从考试说明中不难看出,考核要求是简单的杂化类型判断,对d轨道参与杂化的不作要求,即仅限于sp、sp 2 、sp 3 三种类型的判断,就此三种杂化类型的判断方法作如下归纳。 1、取代法 以中学常见的、熟悉的基础物质分子为原型,用其它原子或原子团取代原型分子中的部分原子...
 [方法与规律e] 价层电子对互斥理论预测的分子空间结构表 作者:傅芳 来源:未知 日期:2020-01-02 09:01:08 点击:9271 所属专题:价层电子对互斥理论
[方法与规律e] 价层电子对互斥理论预测的分子空间结构表 作者:傅芳 来源:未知 日期:2020-01-02 09:01:08 点击:9271 所属专题:价层电子对互斥理论
价层电子对互斥理论预测的分子形状表 电子对数 杂化类型(混层类型) 轨道形状 单电子对数(孤电子对) 分子形状 例 2 sp 直线形 0 直线形 BeCl 2 、CO 2 1 sp 2 平面正三角形 0 平面正三角形 BCl 3 1 sp 2 V字形(角形、弯曲形) SO 2 4 sp 3 正四面体 0 正四面体 CH 4...
 [方法与规律e] 分子(离子)的几何构型的判断方法 作者:范瑞开 来源:未知 日期:2022-07-29 10:22:15 点击:40302 所属专题:分子空间结构判断
[方法与规律e] 分子(离子)的几何构型的判断方法 作者:范瑞开 来源:未知 日期:2022-07-29 10:22:15 点击:40302 所属专题:分子空间结构判断
1、确定中心原子价层电子数。它可由下式计算得到: 价层电子对数=(中心原子价电子数+ 配位原子提供电子数-离子所带电荷数)/2 上式中配位原子提供电子数的计算方法是:氢和卤素原子均提供1个价电子;氧和硫原子提供电子为零。因为氧和硫价电子数为6,它与中心原子成键...
 [方法与规律e] 分子立体结构的判断方法详解 作者:邵磊 来源:未知 日期:2022-07-29 10:20:04 点击:21781 所属专题:分子空间结构判断
[方法与规律e] 分子立体结构的判断方法详解 作者:邵磊 来源:未知 日期:2022-07-29 10:20:04 点击:21781 所属专题:分子空间结构判断
一、价层电子对互斥模型( VSEPRmodels ) 把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。如 CO 2 、 CH 2 O 、 CH 4 等分子中的 C 原子。它们的立体结构可用中心原子周围的原子数来预测,概括如下: 另一类是中心原子上有孤对电子(未用于形成共价键的...
 [方法与规律e] 如何推测简单分子的空间构型? 作者:石峰 来源:未知 日期:2013-04-03 09:33:04 点击:10818 所属专题:空间结构
[方法与规律e] 如何推测简单分子的空间构型? 作者:石峰 来源:未知 日期:2013-04-03 09:33:04 点击:10818 所属专题:空间结构
先求中心原子孤电子对数(m ) 利用经验规律: 可用 AX n a± 来表示只含一个中心原子的分子或离子的组成。 各符号含义: A—— 中心原子 X—— 中心原子结合的原子(可以是一种,也可以是多种) n—— 中心原子结合的原子的总数 公式: m = A 的价电子数-︱ X 的化合...
 [方法与规律e] 中心原子杂化轨道类型的判断方法 作者:陈螯 来源:未知 日期:2014-06-13 11:31:06 点击:21442 所属专题:杂化类型判断
[方法与规律e] 中心原子杂化轨道类型的判断方法 作者:陈螯 来源:未知 日期:2014-06-13 11:31:06 点击:21442 所属专题:杂化类型判断
一、根据分子的空间构型判断 根据杂化轨道理论,中心原子轨道采取一定的杂化方式后,其空间构型和键角如下: 杂化轨道类型 杂化轨道空间构型 键角 sp 直线形 180° sp2 平面三角形 120° sp3 正四面体 109.5° 由此,可以根据分子的空间构型或键角来判断中心 原子轨道的...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...
1.非环状小分子和离子中的大π键:大多数满足AB n 型,可以计算杂化类型。 首先:参与...
1.σ键与π键 σ键:原子轨道沿着轨道对称轴的方向“头碰头”重叠形成的共价键。 π键...