
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑e] 含氢键的物质怎么比较熔点呢? 作者:化学自习室 来源:未知 日期:2024-03-13 08:30:14 点击:4117 所属专题:氢键与熔沸点
[注解与辨疑e] 含氢键的物质怎么比较熔点呢? 作者:化学自习室 来源:未知 日期:2024-03-13 08:30:14 点击:4117 所属专题:氢键与熔沸点
那么含氢键的物质怎么比较熔点呢? 一般要从氢键的强弱程度及数量这两个方面来考量。 But now,我可以直接告诉你: 对于含氢键物质熔点: 水>氟化氢>氨气 (因为就这三种物质含氢键哈哈哈哈哈哈) 这是为什么呢? 每个 HF 分子可以形成 1 个氢键(固态液态都是如此 , ...
 [注解与辨疑e] 怎样全面深入理解“氢键”? 作者:化学自习室 来源:瑞福马斯基 日期:2021-03-12 10:27:35 点击:3048 所属专题:氢键02
[注解与辨疑e] 怎样全面深入理解“氢键”? 作者:化学自习室 来源:瑞福马斯基 日期:2021-03-12 10:27:35 点击:3048 所属专题:氢键02
氢键 氢原子 与电负性大、半径小的原子 X( 氟 、 氧 、 氮 等 ) 以 共价键 结合,若与电负性大的原子 Y( 与 X 相同的也可以 ) 接近,在 X 与 Y 之间以氢为媒介,生成 X-H…Y 形式的一种特殊的分子间或分子内相互作用,称为氢键。 [X 与 Y 可以是同一种类分子,如 水分子...
 [注解与辨疑e] 杂化轨道理论要点讲义 作者:化学自习室 来源:未知 日期:2021-03-07 17:44:17 点击:4502 所属专题:杂化轨道理论
[注解与辨疑e] 杂化轨道理论要点讲义 作者:化学自习室 来源:未知 日期:2021-03-07 17:44:17 点击:4502 所属专题:杂化轨道理论
杂化轨道理论 价键理论简明地阐明了共价键的形成过程和本质,成功解释了共价键的方向性和饱和性,但在解释一些分子的空间结构方面却遇到了困难。例如CH 4 分子的形成,按照价键理论,C原子只有两个未成对的电子,只能与两个H原子形成两个共价键,而且键角应该大约为90°...
 [注解与辨疑e] 超分子简介 作者:化学自习室 来源:未知 日期:2021-03-01 14:52:23 点击:27414 所属专题:超分子
[注解与辨疑e] 超分子简介 作者:化学自习室 来源:未知 日期:2021-03-01 14:52:23 点击:27414 所属专题:超分子
氢键最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。 核酸的双螺旋结构是靠氢键来保持的 神奇的超分子,借分子间作用力形成复杂的组织结构 一、定义: 超分子是由两种或两种以上的分子通过分子间相互作用形成的分...
 [注解与辨疑e] 氢键最全的知识点及其应用 作者:化学自习室 来源:未知 日期:2023-04-27 10:08:13 点击:12807 所属专题:氢键02
[注解与辨疑e] 氢键最全的知识点及其应用 作者:化学自习室 来源:未知 日期:2023-04-27 10:08:13 点击:12807 所属专题:氢键02
一、氢键 1、概念:一种特殊的分子间作用力 2、形成条件:①与电负性大且半径小的原子(F、O、N)相连的 H;②在附近有电负性大, 半径小的原子(F、O、N) 3、表示方法:X—H... Y—。 氢键 氢键是一种静电作用,是除范德华力外的另一种分子间作用力;氢键的大小介于化学键...
 [注解与辨疑e] 常见配合物的空间构型 作者:化学自习室 来源:未知 日期:2022-04-20 09:45:08 点击:5686 所属专题:配合物结构
[注解与辨疑e] 常见配合物的空间构型 作者:化学自习室 来源:未知 日期:2022-04-20 09:45:08 点击:5686 所属专题:配合物结构
配位数 空间构型 结构示意图 实例 2 直线形 [Ag(NH 3 ) 2 ] + [Ag(CN) 2 ] - 4 正四面体 [ZnCl 4 ] 2 [Cd(CN) 4 ] 2- [COCl 4 ] 2- [Cd(NH 3 ) 4 ] 2 平面正方形 [PtCl 4 ] 2- [Ni(CN) 4 ] 2- [Cu(NH 3 ) 4 ] 2+ 6 八面体 [AlF 6 ] 3- [SiF 6 ] 2- [Fe(CN) 6 ]...
 [注解与辨疑e] 有关氢键知识归纳 作者:化学自习室 来源:未知 日期:2020-05-12 09:25:09 点击:3681 所属专题:氢键02
[注解与辨疑e] 有关氢键知识归纳 作者:化学自习室 来源:未知 日期:2020-05-12 09:25:09 点击:3681 所属专题:氢键02
氢键的内容课本上讲得不多,很容易被学生忽略,也是考试中的丢分点,我把有关内容归纳如下: ㈠定义 分子之间存在着一种比分子间作用力稍强的相互作用,这种静电吸引作用就是氢键。 ㈡本质 强极性键(X—H)上的氢核与电负性很大的孤对电子并带有部分负电荷的原子 y 之间的静...
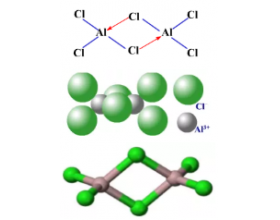 [注解与辨疑e] 氯化铝是极性分子还是非极性分子? 作者:化学自习室 来源:未知 日期:2020-04-02 16:51:17 点击:7130 所属专题:氯化铝 分子极性
[注解与辨疑e] 氯化铝是极性分子还是非极性分子? 作者:化学自习室 来源:未知 日期:2020-04-02 16:51:17 点击:7130 所属专题:氯化铝 分子极性
1、氯化铝是离子化合物还是共价化合物? 成键原子吸引电子能力的强弱可用电负性来度量,一般来说,非金属的电负性大于金属的电负性。成键原子的元素电负性相差越大,原子间形成键的极性就越强。一般来说,当电负性差值大于1.7时,形成的化学键为离子键;当电负性差值小于1.7...
 [注解与辨疑e] 等电子体原理、书写及应用 作者:化学自习室 来源:未知 日期:2022-11-21 08:38:52 点击:6046 所属专题:等电子体
[注解与辨疑e] 等电子体原理、书写及应用 作者:化学自习室 来源:未知 日期:2022-11-21 08:38:52 点击:6046 所属专题:等电子体
(1)比较N 2 和CO的结构、性质,填写下表空格: 分子 N 2 CO 结构 原子数 2 2 电子数 14 14 价电子数 10 10 空间构型 直线形 直线形 性质 沸点/℃ -195.81 -191.49 熔点/℃ -210.00 -205.05 液体密度/G·cm-3 0.796 0.793 (2)根据上表,你能得出的结论是:CO分子和N...
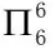 [注解与辨疑e] 高中常见微粒中的大π键问题 作者:化学自习室 来源:未知 日期:2020-01-31 11:54:32 点击:16571 所属专题:大π键
[注解与辨疑e] 高中常见微粒中的大π键问题 作者:化学自习室 来源:未知 日期:2020-01-31 11:54:32 点击:16571 所属专题:大π键
在最近几年全国卷高考化学试题的物质结构与性质选做题中,经常涉及到大π键的考查。例如:2017年全国卷II分子中的大π键可用符号表示,其中 m 代表参与形成的大π键原子数, n 代表参与形成大π键的电子数(如苯分子中的大π键可表示 ),则N 5 - 中的大π键应表示为(答...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。[2025湖北新八校2月卷] 8 . 从微观视角探析物质结构及性质是学习化学的有效方法。下列...
含氮(N)的杂化化合物是指氮原子通过轨道杂化形成化学键的化合物。氮原子的电子构型...
在化学中均裂和异裂是共价键的断裂的两种主要方式,其决定因素不同:均裂主要由键能决...
通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...