一、根据气体的组成元素多少分类
1、单一元素组成的气体
(1)单一元素组成的气体的分类:
①同核单原子分子的气体:稀有气体(He 、Ne 、Ar 、Kr 、Xe 、Rn)。
②同核双原子分子的气体:H
2(
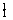
H
2 、
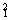
H
2、
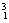
H
2 )、 N
2 、O
2 、F
2 、Cl
2 (
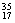
Cl
2 、
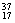
Cl
2)。
③异核双原子分子:
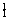
H
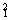
H ,
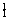
H
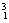
H ,
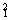
H
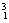
H ;
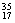
Cl
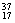
Cl 。
④同核三原子分子的气体:O3 、 H3(新合成)。
⑤同核四原子分子的气体:N4(新合成)。
(2)研究单一元素气体的组成意义:
①高考考点:阿伏加德罗常数考点经常涉及气体分子的组成
例1:判断题:1摩尔任何气体单质分子的原子数都是2NA。(×)
解析:1摩尔稀有气体单质分子的原子数都是N
A,1摩尔双原子气体单质分子的原子数都是2N
A,1摩尔
臭氧气体单质分子的原子数都是3N
A ,所以该判断题错误。
例2:32克氧气和32克臭氧含有的分子数相同。(×)
解析:32克氧气和32克臭氧含有的氧元素的质量相同,氧原子数相同,都是2NA个;但是它们所含的O2 、O3的物质的量不同、分子数不同,同温同压下的体积不同。
规律1:等质量的同素异形体(红磷和白磷、金刚石和石墨、氧气和臭氧)含有的原子个数相同。
规律2:等质量的同分异构体(丁烷和2-甲基丙烷)含有的原子个数相同。
规律3:等质量的同最简式物质(甲醛、乙酸、甲酸甲酯、葡萄糖、果糖)的原子个数相同。
②高考考点:纯净物、混合物的判断
例题:判断题:
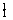
H
2 、
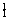
H
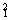
H混合是纯净物,而O
2 、O
3 混合是混合物。(√)
解析:
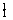
H
2 、
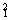
H
2、
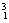
H
2 、
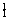
H
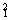
H 、
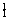
H
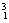
H 、
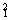
H
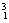
H 这6种单质混合在一起,因其化学性质相同,仍然定义为纯净物,同理
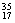
Cl
2 、
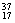
Cl
2 、
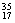
Cl
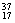
Cl这3种单质混合在一起,仍然定义为纯净物。同素异形体(O
2 和O
3 ;N
2 和N
4 ;H
2 和H
3 )是同一种元素形成的不同单质的互称,单质的化学性质不相同,所以同素异形体混合形成的是混合物。
③高考考点:同位素知识点:不同的同位素原子究竟能构成几种单质分子
例1:
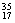
Cl 、
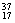
Cl能构成的双原子分子有
种。
例2:
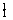
H 、
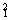
H、
16O 、
18O能构成的水分子有
种。
答案:例1:3 ;例2:6 。
2、两种元素组成的气体
(1)两种元素组成的气体分类:氧化物和氢化物
①气态氧化物分类:二价氧化物(CO 、NO)和四价氧化物(CO2 、NO2 、 SO2)。
研究气态氧化物分类的意义:气态氧化物中非氧元素化合价相同,氧化物的性质相似,具体如下:
ⅰ、二价氧化物(CO 、NO)都是不成盐氧化物,都能使血红蛋白失去载氧能力,人吸入会中毒。
ⅱ、四价氧化物(CO2 、NO2 、 SO2)中CO2 、 SO2 是成盐氧化物中的酸性氧化物,并且都能使澄清石灰水变浑浊。
②气态氢化物分类:按照化学式中氢元素的位置分为两类,一类氢元素在左、一类氢元素在右。
研究气态氢化物分类的意义:同类气态氢化物的性质(溶解性)相似,具体如下:
ⅰ、氢元素在左的气态氢化物有:HF 、HCl 、HBr、 HI 、H2S ,共性(溶解性):溶于水都呈酸性,其中HF 、HCl 、HBr、 HI在空气中都形成白色酸雾。
注意:这里的“氢化物”实质上是非金属与氢气化合的产物的简称,并非科学意义上的氢化物(NaH)。
ⅱ、氢元素在右的气态氢化物有:NH3 和烃分子(含碳原子个数少于等于4个烷烃、烯烃、炔烃),共性(溶解性):所有的气态烃都不溶于水。
3、三种元素组成的气体
⑴三种元素组成的气体分类:卤代烃(CH3Cl:一氯代甲烷)和醛类(HCHO:甲醛)。
⑵研究三种元素组成的气体的意义:高考考点:气体摩尔体积的应用考查了烃的衍生物的状态
例1:判断题:标准状况下,1摩尔任何甲烷与氯气光照反应的产物的体积是22.4升。(×)
解析:甲烷与氯气光照反应的产物有五种:CH3Cl(g)、CH2Cl2(l)、CHCl3(l)、CCl4(l)、HCl(g),其中CH3Cl(g)和HCl(g)是气体,在标准状况下的物质的量为1摩时的体积是22.4升。
例2:判断题:标准状况下,1摩尔乙醛的体积是22.4升。(×)
解析:在醛类中,只有甲醛是气体,在标准状况下,1摩尔甲醛的体积是22.4升。
二、根据气体分子的电子数和相对分子质量两个角度分类
4、根据气体分子的电子数分类
(1)、电子数为10(Ne)的分子构成的氢化物气体: HF NH3 CH4
意义(氢化物水溶液酸碱性的递变规律):按照氢化物中非氢元素的质子数由大到小顺序氢化物的水溶液酸碱性递变规律:酸性→碱性→中性。
(2)、电子数为14的分子构成的气体:N2 CO C2H2
意义1:电子数相同,结构相似:分子内都含有三键(氮氮三键、碳氧双键和一个配位键、碳碳叁键)。
意义2:1摩尔N2 和1摩尔CO具有相同的分子个数、原子个数、质子数、电子数、质量。
5、根据相对分子质量分类
(1)、相对分子质量为28的分子构成的气体:N2 、CO 、C2H4
(2)、相对分子质量为44的分子构成的气体:N2O 、CO2 、 C3H8
意义:在同温同压下,质量相同的N2O和CO2 气体的体积相同。
三、根据气体分子的极性分类
6、极性分子构成的气体:HF 、HCl 、HBr、 HI 、H2S、NH3 、CO 、NO、 NO2 、SO2
意义:根据
相似相溶原理,极性分子易溶于极性溶剂中,HCl 和NH
3极易溶于水,可以用来做喷泉实验。
注意1:CO 、NO不溶于水。
注意2:存在溶解平衡的气体:SO2 。
有关化学方程式:SO2 + H2O ? H2SO3
注意3:发生岐化反应的气体:SO2 。
有关化学方程式:3NO2 + H2O =2 HNO3 +NO
注意4:溶于水发生电离溶液呈酸性的气体:HF 、HCl 、HBr、 HI 、H2S。
有关电离方程式:HCl=H+ + Cl- , HBr=H+ + Cl- , HI=H+ + I- ;
HF?H+ +F- , H2S?H+ +HS- , HS- ?H+ + S2- 。
注意5:溶于水发生电离溶液呈碱性的气体:NH3 。
有关电离方程式:NH
3 +H
2O
?NH
3 ·H
2O
?NH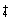 +OH-
+OH-7、非极性分子构成的气体:H2 、N2 、O2 、F2 、Cl2 、CH4 、C2H4 、C2H2 、CO2
意义:根据相似相溶原理,非极性分子不易溶于极性溶剂(水)中,大多数非极性分子的气体不溶于水,例如:H2 、N2 、CH4 、C2H4 、C2H2 。
注意1:O2能溶于水,1体积水溶解的氧气不到1体积。
注意2:存在溶解平衡的气体:Cl2 和CO2 。
有关化学方程式:Cl2 +H2O ? HCl +HClO ,CO2 + H2O ? H2CO3
注意3:与水强烈反应的气体(反常):F2 。
有关化学方程式:2F2 +2H2O=4HF+O2 ↑
四、根据物理性质分类(颜色、气味、密度、溶解性、露点、毒性)
8、根据颜色分类:
(1)、有颜色的气体:F2 (淡黄绿色)、Cl2 (黄绿色)、NO2(红棕色)。
(2)、气体本身无色,遇到空气中的氧气变色红棕色(NO2)的气体:NO 。
意义:高考考点:气体鉴别、作为无机框图题的题眼、解题的突破口。
9、根据气味分类
(1)、无味的气体:H2 、N2 、O2 、CH4 、C2H4 、C2H2 、CO2
(2)、有刺激性气味的气体:F2 、Cl2 、O3 、NO2 、SO2 、HF 、HCl 、HBr、 HI 、H2S、NH3
(3)、有特殊气味的气体:H2S(臭鸡蛋气味的气体)、NH3
意义:高考考点:气体鉴别;紧急自救:氯气中毒可以吸入氨气解毒。
10、根据密度分类
(1)、密度比空气密度小的气体(气体分子的相对分子质量小于29):H2 、CH4 、C2H2 、NH3
(2)、密度接近空气密度的气体(气体分子的相对分子质量接近29):N2 、C2H4 、NO
(3)、密度比空气密度大的气体(气体分子的相对分子质量大于29):O2 、CO2 、F2 、Cl2 、O3 、NO2 、SO2 、HF 、HCl 、HBr、 HI 、H2S
意义:根据气体密度的大小,决定实验室收集该气体的方法。密度比空气密度小的气体用向下排空气法收集,密度比空气密度大的气体用向上排空气法收集,密度接近空气密度的气体不能用排空气法收集。
规则:同温同压下密度之比等于摩尔质量之比,摩尔质量与相对分子质量数值相等,比较密度大小实际上就是比较相对分子质量的大小,组成空气的成分气体分子的平均相对分子质量是29。
11、根据溶解性分类
(1)、不溶于水的气体:H2 、N2 、CH4 、C2H4 、C2H2 、CO 、NO
(2)、能溶于水的气体:O2 、CO2 、Cl2、 、H2S 、SO2
(3)、极易溶于水的气体:NO2 、HF 、HCl 、HBr、 HI 、NH3 。
意义:
◆极易溶于水的气体的尾气可以考虑用水吸收法处理,采取放倒吸装置。
◆不溶于水的气体用排水法收集。
◆能溶于水的气体用排相对应的饱和溶液的方法收集:
CO2-----饱和碳酸氢钠溶液
SO2------饱和的亚硫酸氢钠溶液
Cl2------饱和食盐水
◆极易溶于水的气体的既不能用排水法收集也不能用排饱和溶液的方法收集,只能用排空气法收集。
12、根据露点分类
易液化的气体:Cl2、、NO2 、SO2 、NH3 。
意义:鉴别气体,利用液化分离气体,液NH3做致冷剂。
13、根据毒性分类
(1)、没有毒的气体:H
2 、N
2 、CH
4 、C
2H
4 、C
2H
2 、O
2 、CO
2 、NH
3 。

(2)、有毒的气体:F2 、Cl2 、O3 、NO 、NO2 、SO2 、H2S 、CO
意义:有毒气体的制备和性质实验应在通风橱内进行。
五、根据化学性质的分类(酸碱性、氧化还原性、络合性、热稳定性、特性)
14、根据水溶液的酸碱性分类
(1)、水溶液呈酸性的气体:F2 、Cl2 、CO2 、NO2 、SO2 、HF 、HCl 、HBr、 HI 、H2S
①溶于水电离呈酸性的气体:HF 、HCl 、HBr、 HI 、H2S
②与水发生置换反应溶液呈酸性的气体:F2 ,化学方程式:2F2+2H2O=4HF+O2 ↑
③与水发生
歧化反应溶液呈酸性的的气体:Cl
2 、NO
2 。
化学方程式:Cl2 +H2O=HCl+HClO ;3NO2+2H2O=2HNO3+NO
④与水发生化合反应溶液呈酸性的的气体:CO2 、SO2 。
化学方程式:CO2 +H2O?H2CO3 ;SO2 +H2O?H2SO3
⑤溶于水发生化合反应溶液呈碱性的气体:NH3 ,化学方程式:NH3+H2O?NH3 ·H2O
(2)根据气体水溶液的酸碱性进行分类的意义:
①高考考点:判断气体能否共存,为混合气体的成分推断提供解题依据。
因为酸碱性而不能共存的气体有:NH3与HF(HCl 、HBr、 HI 、H2S)。
②使澄清石灰水变浑浊的气体:CO2 、SO2 、HF ,其中CO2 、SO2过量后浑浊又变澄清。
③使紫色石蕊试液变红色的气体:CO2 、SO2 、HF 、HCl 、HBr、 HI 、H2S
④能和硝酸银溶液反应产生沉淀的气体:Cl2 、HCl(白色),HBr(浅黄色),HI(黄色),H2S
(黑色),NH3(褐色)。
⑤为选择干燥剂提供依据:
ⅰ、能用浓硫酸干燥的气体:中性和酸性气体(不与浓硫酸反应的气体)H2 、O2、Cl2 、CO2 、SO2 、HF 、HCl 。
ⅱ、能用
碱石灰干燥的气体:中性和碱性气体(不与碱石灰反应的气体)H
2 、O
2、NH
3 。
ⅲ、能用氯化钙干燥的气体:(不与氯化钙反应的气体)H2 、CH4 、C2H4 、C2H2 、O2 、Cl2 、NO 、NO2 、SO2 (氨气与氯化钙发生络合反应:CaCl2 +8NH3 =CaCl2 ·8NH3)
15、根据氧化还原性分类:
(1)、根据氧化还原性对气体的分类:
①氧化性为主的气体:F2 、Cl2 、NO2 、O3 、O2
②还原性为主的气体:HI 、H2S 、H2 、CO 、NH3 、HBr
③在与水的反应中既体现氧化性又体现还原性的气体:Cl2 、NO2
④遇到强氧化剂呈还原性,遇到强还原剂呈氧化性的气体:SO2 、NO
⑤利用强氧化性漂白的气体有:Cl2 、O3(氧化漂白、永久漂白)
(2)根据氧化还原性对气体分类的意义:
①判断气体能否共存提供依据;因为发生氧化还原反应而不能共存的气体组有:H2 和F2 ,H2S 和SO2 ,Cl2 和H2S ,Cl2 和HI,Cl2 和HBr,NO和O2 。
②为选择干燥剂提供依据:浓硫酸具有强氧化性,不能干燥还原性气体:HBr、 HI 、H2S
③使溴水和高锰酸钾溶液褪色的气体:H2S 、SO2(还原性气体),C2H4 、C2H2(不饱和气体)。
④使湿润的碘化钾淀粉试纸变蓝色的气体:Cl2 、O3 、NO2(氧化性气体)。
⑤能还原氧化铜的气体:H2 、CO 、NH3 ,有关化学方程式:
H
2+CuO

H
2O+Cu
CO +CuO
CO
2+Cu
2NH3+3CuO
3Cu+N
2 +3H
2O
⑥氢气用于高纯硅的制备,有关化学方程式:2H
2+SiCl
4
Si +4HCl
16、根据络合性分类
能发生络合反应的气体有:CO 、NO 、NH3
(1)、CO 、NO 与血红蛋白中的亚铁离子发生络合能力比氧分子强,使血红蛋白失去载氧能力,人吸入会中毒。
(2)、NH3与AgOH 、Cu(OH)2 、Zn(OH)2发生络合反应,使沉淀发生溶解。
(3)、NH3与CaCl2发生络合反应,生成CaCl2 ·8NH3,所以实验室不能用CaCl2来干燥NH3 。
意义:解释一些化学现象。
17、根据热稳定性分类
受热不稳定的气体有:HI 、H2S
意义:研究可逆反应是经常用到该知识点,NH4I的连续两次分解反应的平衡计算问题。
18、特性
SO2使品红溶液褪色,加热、时间久了颜色又会出现,褪色的机理是SO2与品红溶液发生化合反应,生成不稳定的无色化合物,在加热条件下或者长时间放置,该产物分解,放出SO2,品红溶液颜色重新出现。
六、根据气体的制备反应原理对气体进行分类
根据反应原理选择气体的制备装置:
◆固+液→气,选择制备氢气的简易装置(广口瓶、带有长颈漏斗和导气管的双口塞),符合
启普发生器(球型漏斗、葫芦形容器、带有导气管的单口塞)使用条件的还可以用启普发生器。
◆固+液

气 ,选择制氯型装置:铁架台、酒精灯、铁圈、石棉网、圆底烧瓶、带有分液漏斗和导气管的双口塞。
◆固+固

气,选择制氧型装置(酒精灯、硬质试管、铁夹、带有导气管的单口塞)。
19、利用氧化还原反应原理制备的气体:H2 、NO 、NO2 、SO2 、Cl2 、O2
(1)、利用非氧化性强酸的还原反应制备的气体:H2
有关化学方程式:Zn+H2SO4=ZnSO4+H2 ↑
(2)、利用氧化性强酸的还原反应制备的气体:NO 、NO2 、SO2
有关化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2 ↑+4H2O
Cu+2H
2SO
4(浓)

CuSO
4+SO
2 ↑+2H
2O
(3)、利用还原性酸的氧化反应制备的气体:Cl2
有关化学方程式:MnO
2+4HCl(浓)

MnCl
2 +Cl
2↑+2H
2O
(4)、利用分解反应制备的气体:O2
有关化学方程式:2KMnO
4
K
2MnO
4+MnO
2 +O
2 ↑ ,2H
2O
2 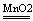
2H
2O+O
2 ↑
20、利用复分解反应原理制备的气体:CO2 、NH3 、H2S 、SO2 、HCl 、HF 、HBr 、HI
(1)、强酸和弱酸盐的复分解反应制备的气体:CO2 、H2S、SO2 ;有关化学方程式:2HCl+CaCO3=CaCl2+H2O+CO2 ↑ ;
2HCl+FeS=FeCl2+H2S↑
H2SO4 +Na2SO3 =Na2SO4+ H2O+SO2 ↑
(2)、难挥发性酸和挥发性酸对应的盐的复分解反应制备的气体:HCl 、HF 、HBr 、HI
有关化学方程式:
H2SO4(浓)+CaF2=CaSO4+2HFl ↑
H2SO4(浓)+2NaCl=Na2SO4+2HCl ↑
H3PO4(浓)+NaBr=NaH2PO4+HBr ↑
H3PO4(浓)+KI=KH2PO4+HI ↑
(3)、盐和碱的复分解反应制备的气体:NH3
2NH
4Cl+Ca(OH)
2
CaCl
2+2NH
3 ↑+2H
2O
21、利用脱羧反应原理制备的气体:CH4
CH
3COONa+NaOH

Na
2CO
3+CH
4 ↑
22、利用乙醇与浓硫酸在170℃的条件下发生消去反应制备的气体;C2H4
CH
3CH
2OH

CH
2=CH
2 ↑ +H
2O
23、利用水解反应原理制备的气体:C2H2
CaC2 +2H2O→Ca(OH)2 +C2H2 ↑
七、根据气体的制备实验装置进行分类
24、用制氢型装置来制备的气体:H2 、NO 、NO2 、SO2 、CO2 、H2S 、HF
25、可以用启普发生器制备的气体:H2 、CO2 、H2S
26、用制氯型装置制备的气体:SO2 、Cl2 、HCl 、HBr 、HI
27、用制氧型装置制备的气体:NH3 、O2 、CH4 、HCl 。
意义:根据药品不同,选择不同的制备装置。
◆制备二氧化硫:给你铜和浓硫酸,选择制氯型装置,给你亚硫酸钠和稀硫酸,选择制氢型装置。
◆制备氯化氢:给你氯化钠和浓硫酸,选择制氯型装置,给你氯化钠和硫酸氢钠,选择制氧型装置。
(责任编辑:化学自习室)



 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。