
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
辩证唯物主义观点认为,世界是物质的,物质是不断变化运动的。化学研究的对象是物质,化学学科研究物质的组成、结构、性质、变化以及合成等。由此可见,化学知识的各个领域渗透着辩证法。我们若用哲学观点为指导,定能形成正确的唯物主义世界观,发展辩证思维,提高分析、解决问题的能力,加深对化学知识的理解与掌握。
一、物质世界是关联的,一定条件下可以相互转化。
自然辩证法认为,各种事物的变化、发展不是孤立的,而是相互联系、互相制约的。一方面,化学学科和其它学科之间存在着广泛的联系,物理、数学的许多方法与手段被大量应用于化学中,化学为材料、机械、医药、航空等科学提供了大量的新型材料。现代的科学研究的方向将集中在各学科之间的交叉处发展,即进行许多交叉学科的研究,如生物化学、无机化学、分子生物学、化学计量学、超导化学、量子化学等。
另一方面,化学学科中也普遍存在紧密的联系,认识它们之间普遍联系,将大大提高认知效率。例如,学习元素化合物知识时,为深刻揭示物质的化学性质及其它们之间的相互转化,常常把所学知识按点→线→面→体的网络系统进行概括、比较和提高。如氮及其化合物知识学习后,可以应用下列知识网络进行总结:
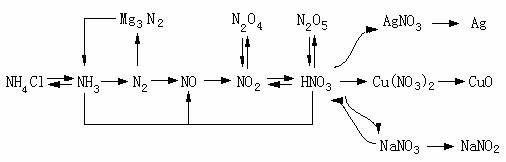
元素周期表揭示了元素的结构、位置和性质之间的联系,我们在认识不熟悉物质性质时,可利用同主族元素性质相似性和递变规律,从已知元素推导而出,如由镁、钙、钡推论不难得知,镭与水较易反应生成可溶的氢氧化镭和氢气,镭与稀硫酸则难于反应,因为硫酸镭不溶于水,镭与稀硫酸一开始生成的硫酸镭附着在镭表面阻止反应,碳酸镭不溶于水,氯化镭、硝酸镭易溶。镭与镁性质相似能和氮气、氧气、硫等非金属剧烈反应等等。从上可知,运用联系的观点,很易连成知识链,结成知识网,我们若掌握好基础,充分发挥联想,就能系统掌握化学知识。
二、事物变化的内因与外因
事物发生变化的根本原因,在于事物内部的矛盾性。内因是事物发生变化的根据,外因是变化的条件,外因通过内因而起作用。我们学习物质的性质时,可以此原理为指导:物质的性质由结构决定(元素的性质由原子结构决定,单质化合物的性质由分子结构及晶体结构决定),而物质的性质又决定其用途。这个结构——性质——应用的因果关系,将为我们的学习形成一种水到渠成的格局,达到深刻理解。如,对石墨的认识如下:一个碳原子和其余三个碳原子以共价键形成平面正六边形网状结构——高熔点——制作耐高温坩埚;层状结构,层与层之间的较小的范德华作用力结合——软、滑腻感——做铅笔芯、润滑剂;每个碳有一个能量高的电子(自由电子)——不透明(黑色),导电性——电极材料。
又如,研究化学反应速率及化学平衡时,我们知道,通常条件下,各种物质分别的反应速率不同,达平衡时反应物的转化率不同:盐酸和氢氧化钠稀溶液反应极快,几乎完全反应,K=1014,氮气和氢气合成氨则反应很慢,且平衡时混合气体中氨的百分率较低,乙烷和水生成乙醇的反应则不能进行。这是由各物质的本质(内因)决定的。但是,反应速率的大小,化学平衡建立是相对的,暂时的。我们可以通过一些外界条件(外因)的改变对其作用。采用实验探究的方法,知道加快氨合成速率,提高氨平衡转化率的适宜压强、温度、浓度及合适的催化剂,最后利用对比、综合、验证得出合成氨的最佳条件,温度:400~520℃,浓度:不断充入体积比1:3氮氢混合气,分离出氨,压强200~500大气压,催化剂:铁触媒。研究化学反应速率和化学平衡,始终贯穿着内因和外因的哲学思想,变化的内因不成立,外因的作用将不会有结果,如进行改变条件实现乙烷和水反应生成乙醇的研究是徒劳的。
三、量变会引起质变
量的积累可以引起质的飞跃,这种观点可以指导我们认识众多的化学规律。在元素周期表中,同周期元素从左到右随核电荷数递增,金属性逐渐减弱,非金属性逐渐增强。如第三周期元素从左到右完成了由典型的活泼金属元素(钠)、两性元素(铝),典型的活泼非金属元素(氯)的转变,同主族元素从上到下随核电荷数递增,电子层数增加,也有类似的变化规律,这充分说明了由量变引起质变的过程。相同元素组成的化合物中,元素化合价的变化,引起还原性向氧化性的递变,如硫化氢只有还原性,硫、二氧化硫既有还原性,又有氧化性,三氧化硫、硫酸只有氧化性。许多反应由于反应物量的配比不同而生成不同的产物。如石灰水中通入少于氢氧化钙物质的量的二氧化碳气体时,溶液变混浊,Ca(OH)2+CO2=CaCO3+H2O,当二氧化碳的物质的量多于氢氧化钙时,混浊液又变澄清,CaCO3+H2O+CO2=Ca(HCO3)2。
又如,当一定量的磷酸溶液中逐滴加入氢氧化钠溶液时,生成产物如下变化(水除外):
|
(x) |
0<x≤1 |
1<x<2 |
x=2 |
2<x<3 |
x=3 |
||
|
产 物 |
NaH2PO4 |
NaH2PO4 Na2HPO4 |
Na2HPO4 |
Na2HPO4 Na3PO4 |
Na3PO4 |
(x)
一定量的氢氧化钠溶液中逐滴加入磷酸溶液时,生成产物又是如下变化(水除外):
|
nNaOH |
0<x≤1/3 |
1/3<x<1/2 |
x=1/2 |
1/2<x<1 |
x=1 |
|
产 物 |
Na3PO4 |
Na2HPO4 Na3PO4 |
Na2HPO4 |
NaH2PO4 Na2HPO4 |
NaH2PO4 |
运用量变引起质变的原理,学习相关化学知识时,我们只要掌握有关变化规律,抓住关键的转折点(质变点),就等于找到了解决问题的方法。
四、矛盾的对立统一
评价一件事物,一般要从正反两方面来进行分析,即事物变化发展往往有一对矛盾相互作用,它们是对立的,但作用的结果往往成为有机的统一体系。比如你认为电动汽车代替现在的燃油汽车,就可消除一氧化碳,氮氧化物,碳微粒对空气的污染,但大量使用铅蓄电池的电动车,会到处有废弃的旧电池,引起可怕的铅污染。
在化学学习中,我们可以用对立统一的思维法则来分析问题,得出正确的结论。如离子键的形成可以这样描述,活泼非金属原子和活泼金属原子相互作用,发生得失电子,形成阴阳离子,阴阳离子间存在异号电荷的吸引力及电子与电子、原子核电荷与核电荷之间的排斥力,在阴阳离子间距较大时,主要表现为吸引力,但当阴阳离子相互靠近时,排斥力迅速增加,离子间距达到一定程度,吸引和排斥力大小相等,方向相反,成为一种平衡状态而形成离子键,所以正确的结论为:阴阳离子通过静电作用(吸引与排斥)形成的化学键叫做离子键。对立统一规律是普遍存在的。例如,物质的化合与分解、氧化与还原、溶解与结晶、中和与盐的水解,原电池与电解池等等。运用对立统一的观点分析问题,可以揭示事物变化发展的本质规律,从而深刻理解掌握有关知识。
五、主要矛盾和次要矛盾
事物表现的性状,有很多因素(即矛盾的各个方面)作用的结果,在众多矛盾中,必然有一个是主要的。只要我们抓住主要矛盾,一切问题就迎刃而解了。如,胶体溶液中的胶粒直径是一般溶质微粒的一百倍,体积是溶质微粒的一百万倍,为什么如此大的微粒还会在分散剂中稳定存在呢?这里面有几个因素影响:一是胶粒带有同种电荷,它们相互间排斥力较大;二是在分散剂分子不断撞击下,胶粒作布朗运动;三是胶粒本身作热运动。经研究,主要矛盾是第一个因素,胶粒之间较大的电性斥力阻止了胶粒相互靠近形成沉淀。抓住了主要矛盾,我们很易理解掌握胶体凝聚的原理和方法:加入电解质,加热,加胶粒带有相反电荷的胶体,可以中和或减弱胶粒的荷电,相互凝聚成较大颗粒而沉淀。
![]() 氢氧化镁不溶于水,却能溶于浓氯化铵溶液中,这是为什么?一般有以下两种解释:一是氢氧化镁在水中存在溶解平衡,Mg(OH)2(s) Mg2++2OH-,氯化铵在溶液中存在水解平衡,
氢氧化镁不溶于水,却能溶于浓氯化铵溶液中,这是为什么?一般有以下两种解释:一是氢氧化镁在水中存在溶解平衡,Mg(OH)2(s) Mg2++2OH-,氯化铵在溶液中存在水解平衡,![]() 两者混合后,氢离子和氢氧根中和生成水,使平衡体系内氢氧根离子浓度减小,氢氧化镁溶解平衡不断向右移动而溶解;二是认为浓氯化铵溶液提供的铵根离子结合氢氧根离子生成弱碱,NH4++OH-=NH3·H2O,使氢氧化镁溶解平衡不断向右移动而溶解的。那么哪种解释是正确的呢?我们知道,在浓氯化铵溶液中,铵根离子浓度很大的(氯化铵是可溶强电解质),氢离子浓度则很小(铵根离子水解程度小,溶液越浓,更不利于水解),所以第二个因素是矛盾的主要方面,第一个因素是次要的,应略去。在分析问题时,我们要通过事实数据列出影响事物性质的各个因素,运用联想,对比和比较的手法,加以抽象,找到主要矛盾,从而顺利地解决问题。
两者混合后,氢离子和氢氧根中和生成水,使平衡体系内氢氧根离子浓度减小,氢氧化镁溶解平衡不断向右移动而溶解;二是认为浓氯化铵溶液提供的铵根离子结合氢氧根离子生成弱碱,NH4++OH-=NH3·H2O,使氢氧化镁溶解平衡不断向右移动而溶解的。那么哪种解释是正确的呢?我们知道,在浓氯化铵溶液中,铵根离子浓度很大的(氯化铵是可溶强电解质),氢离子浓度则很小(铵根离子水解程度小,溶液越浓,更不利于水解),所以第二个因素是矛盾的主要方面,第一个因素是次要的,应略去。在分析问题时,我们要通过事实数据列出影响事物性质的各个因素,运用联想,对比和比较的手法,加以抽象,找到主要矛盾,从而顺利地解决问题。
六、矛盾的普遍性和特殊性
化学物质之间的共性和个性充分体现了矛盾的普遍性与特殊性之间的关系。如一般情况下,卤化氢气体均是无色有刺激性气味的气体,空气中会形成白雾,极易溶于水,水溶液强酸性,这是它们的共性,但氟化氢的性质有特殊的地方:有剧毒,水溶液酸性较弱。又如,一般增加体系的总压强会使化学平衡向气体物质的量减小方向移动,但是,如果用向固定体积的密闭容器中通入惰性气体的方式增大总压强,则原平衡不会发生移动。
运用矛盾的普遍性和特殊性观点,有助于我们认识各事物性质的一般规律,又提醒我们注意各事物的特征,前者有利于“举一反三”,丰富知识范畴,后者有利于弱化思维定势,形成全面、严谨的思维习惯。
在化学学习中,我们不仿设计从个体到群体,从一般到特殊的认知过程,这种顺序既符合化学科学知识体系的编排,又符合辩证唯物主义的思维法则。如,在学习卤素这章内容,我们先掌握氯单质的结构物理性质、化学性质,然后以此为线索,运用实验并加以联想便容易认识卤单质的共性(双原子分子,有色,水中溶解度小,有机溶剂中易溶,与绝大多数金属反应生成卤化物,与氢气反应生成卤化氢,与水、与碱溶液发生歧化)。最后,以比较手法找出氟、溴、碘结构与性质特点,并抽象,得出卤素原子结构、卤素单质物理、化学性质递变规律,从而系统、全面掌握了卤素单质有关知识。
七、绝对真理和相对真理,事物的发展是前进的、螺旋上升的
真理是客观事物及其规律在人的意识里的正确反映。从其内容看,真理是客观的,从认识真理的过程看,真理是一个从相对走向绝对的逐步深化的过程。例如,学生对氧化还原经历了得氧失氧,化合价升降,电子失得的过程,才从本质上认识;科学的原子模型经历了道尔顿模型、汤姆生模型、卢瑟福模型、玻尔模型和薛定锷模型五个阶段,使人们对原子模型的认识逐渐加深,日趋完善。在这个过程中,所含绝对真理的成份依次增多,而相对真理部分则随着科学的进步不断变动和改进。
事物在不断地发展,人们对真理的认识随之不断深化。唯物辩证法认为,事物的发展总是由肯定阶段走向否定阶段,事物的发展过程具有螺旋式,波浪式上升的性质。例如,随原子序数的递增,元素的性质呈周期性变化,并不是简单的重复,而是螺旋式的上升,所以在元素周期律的具体表现形式——周期表中,有同一周期从左到右,金属性依次减弱,非金属性依次增强,又有同一主族从上到下,金属性依次增强,非金属性依次减弱的递变。我们在教学中,要以实验为基础,使学生获取丰富、生动的感性认识,再通过分析、综合、抽象和概括,掌握原理和规律,并使认识不断深化。
综上所述,用唯物辩证法指导化学学习是成功的。化学是一门自然科学,更是门实验学科,在学习中,让我们教导学生遵循实践——认识——再实践——再认识的辩证唯物主义认识论观点,充分运用化学丰富的形象直观材料、信息,以科学的思维方法,实现由感性认识上升到理性认识之飞跃,扎扎实实掌握好化学知识,为生产、生活和科学实验服务。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。化学是研究物质变化的科学 化学研究物质的组成、结构、性质、变化以及伴随这些变化发...
哲学是干什么的?据说一百个哲学家有一百种回答。中学阶段对哲学的定义是什么? 我的...
中学化学课本中有大量的数据材料用来说明物质的性质及其变化。许多化学理论、原理、规...
前言:高中的几年是学生生涯中很重要的阶段,但也正因它有三年时间,我们有些同学觉得...
对于基础不好的同学来说,最痛苦的事情就是,听课好不容易听懂了,一做题发现自己都不...
一、化学学科的特点 化学是建立在实验基础上的、对物质的结构和物质的组成、结构、性...