
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在错综复杂的化学变化中,抓住反应前后某些量保持不变,即“守恒”作为解题依据,可以简化计算步骤,提高解题速度和准确度。与铁及其化合物有关的众多计算题中,能运用守恒原理巧妙解答的题型特别多,只要解题时运用得当,可事半功倍。其常见题型及守恒关系可归纳如下:
一、质量守恒关系
例1.在2L硫酸铜和硫酸铁的混合溶液中,加入30g铁粉,最后得到2L0.25g·mol-1的硫酸亚铁溶液及26g固体沉淀物。分别求原混合溶液中硫酸铁和硫酸铜的物质的量浓度。
[思路探索]
设硫酸铁、硫酸铜的物质的量分别为x和y。根据反应前后铁和铜的质量和相等得:
56g·mol-1×2x+64g·mol-1×y+30g=2L×0.25g·mol-1×56g·mol-1+26g ①
再由反应前后硫酸根离子的物质的量守恒得:
3x+y=2L×0.25g·mol-1②
联立①②解得x=0.1mol,y=0.2mol。
因此硫酸铁、硫酸铜的物质的量浓度分别为0.05mol·L-1和0.1mol·L-1。
[思维拓展]
质量守恒定律表示:参加化学反应的各种物质的质量总和,等于反应后生成物的各物质的质量总和。依据该定律常可得出下列解题时实用的等式:
(1)反应物的质量总和=生成物的质量总和
(2)反应物减少的总质量=产物增加的总质量
(3)反应体系中固体质量的增加(或减少)等于气体质量的减少(或增加)
二、元素守恒关系
例2.把铁、氧化铁、氧化铜的混合物粉末放入110mL4mol·L-1盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.4mol·L-1。试求原混合物的总质量。
[思路探索]
因滤液显酸性(即盐酸过剩),所以,残留固体只可能是铜,据题意可得反应物和生成物变化的“纲要信号”图:
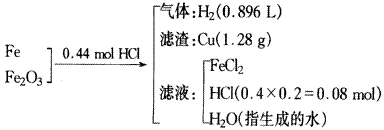
由Cu元素守恒可得: n(CuO)=n(Cu)=1.28g/64g·mol-1=0.02mol
由氯元素守恒可得: 2n(FeCl2)+n(HCl余)=n(HCl总)=0.44mol
即2n(FeCl2)+0.08mol=0.44mol,则n(FeCl2)=0.18mol。
又由氢元素守恒可得: 2n(生成H2O)+2n(H2)+n(HCl余) =n(HCl总)=0.44mol,
解得反应产物中水的物质的量为n(生成H2O)=0.14mol。
由氧元素守恒可得: 3n(Fe2O3)+n(CuO)=n(生成H2O),
解得:n(Fe2O3)=0.04mol
最后由铁元素守恒可得: n(Fe)+2n(Fe2O3)=n(FeCl2)
解得:n(Fe)=0.1mol
综上可知,原混合物总质量为: 56g·mol-1×0.1mol+160g·mol-1×0.04mol+80g·mol-1×0.02mol=13.6g
[思维拓展]
在化学反应过程中,从某种意义上说可以认为是原子重新组合的过程,因此在反应过程中某种元素的原子,在反应前后必定保持两种守恒关系(均体现出原子个数相等):
(1)原子的质量守恒;
(2)原子的物质的量守恒。
三、电荷守恒关系
例3.已知2Fe2++Br2=2Fe3++2Br-,当向100mL的FeBr2溶液中通入标准状况下的Cl23.36L,充分反应后测得形成的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为多少?
[思路探索]
由题供信息可知:Fe2+的还原性强于Br-的还原性;因此,通入Cl2后Fe2+应该全部被氧化成了Fe3+。
据题意知反应后的溶液中只有Fe3+、Cl-、Br-,且n(Cl-)=n(Br-)=2n(Cl2)=2×3.36L/22.4L·mol-1=2×0.15mol。
据电荷守恒原理,必有: 3n(Fe3+)=n(Cl-)×1+n(Br-)×1
解得:n(Fe3+)=0.2mol
又由铁元素守恒知n(Fe2+)=n(Fe3+)=0.2mol。
故原FeBr2溶液的物质的量浓度为: 0.2mol/0.1L=2mol·L-1
[思维拓展]
在电解质溶液里或在离子化合物中,所含阴、阳离子的电荷数必定相等(电中性原理),即阳离子的物质的量(或物质的量浓度)×阳离子的电荷数=阴离子的物质的量(或物质的量浓度)×阴离子的电荷数。
四、电子守恒关系
例4.将14g铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8g,则原溶液中硝酸的浓度为()
A.0.4mol·L-1 B.0.6mol·L-1 C.0.8mol·L-1 D.1.0mol·L-1
[思路探索]
按常规解本题需先判断出反应中同时生成了+2、+3价的铁,然后再根据方程式求解。若运用守恒原理则可避开繁琐的讨论和方程式的书写。
假设铁单质在反应中被氧化成+n价,由题意有:
Fe-ne-→Fe(NO3)n→nHNO3(反应中作酸用的)
1n n
(14/56)mol 0.25nmol 0.25nmol
由题意知,产生气体NO的质量为14g-8g=6g,物质的量为6g/30g·mol-1=0.2mol。
则有HNO3(反应起氧化剂作用的)+3e-→NO
1 3 1
0.2mol 0.6mol 0.2mol
据电子的守恒原理可得0.25n=0.6;又由氮元素守恒原理可推知,反应中共消耗硝酸的物质的量为: 0.25nmol+0.2mol=0.8mol
故选C。
例5.在100mL的FeBr2溶液中,通入2.24L的标准状况下的氯气,充分反应后,溶液中有1/3的Br-被氧化成溴单质。求原FeBr2溶液的物质的量浓度。
[思路探索]
设FeBr2溶液的物质的量浓度为xmol·L-1,根据氧化还原反应中氧化剂和还原剂得失电子数相等的原则知,Cl2所得电子的物质的量应等于Fe2+和Br-所失电子的物质的量之和。
则有: 2.24L/22.4L·mol-1×2=0.1x×1+(0.1x/3)×2×1
解得x=1.2。因此,原FeBr2溶液的物质的量浓度为1.2mol·L-1。
[思维拓展]
氧化还原反应的本质是参加反应的原子间的电子转移(包括电子得失和电子对的偏移)。在氧化还原反应过程中,氧化剂得到电子的总物质的量必定等于还原剂失去电子的总物质的量。在解有关氧化还原反应的试题(尤其是涉及多个氧化还原反应的综合题)时,运用电子守恒法可起到事半功倍的效果。
五、体积守恒关系
例6.将5.6g铁粉与6.4g硫粉在隔绝空气的条件下加热充分反应后冷却至室温,再在其固体中加入足量的稀硫酸反应至固体不再溶解,所制得的气体在0℃、1.01×105Pa下的体积约为( )。
A.2.24L B.2.34L C.2.80L D.4.48L
[思路探索]
加热时发生的化学反应为: Fe+S=FeS
与足量稀硫酸发生的化学反应可能有:Fe+H2SO4=FeSO4+H2↑ FeS+H2SO4=FeSO4+H2S↑
从上述反应方程式分析可发现如下变化关系:Fe→FeSO4→H2;Fe→FeS→H2S。
即1molFe经充分反应后,最终能生成1mol气体(可能是H2S,也可能是H2和H2S的混合气),而与硫粉的质量多少无关。因题中Fe粉的物质的量为0.1mol,所以,生成气体也恒为0.1mol,标准状况下的体积为2.24L。应选A。
[思维拓展]
在有些化学反应中,反应前、后气态物质的物质的量是不变的,即在相同的条件下,反应前、后气体的体积守恒。
例如: H2+Cl2![]() 2HCl CS2+3O2
2HCl CS2+3O2![]() CO2+2SO2
CO2+2SO2
六、综合守恒关系
例7.已知有关物质及离子的氧化性顺序为:浓硫酸>Fe3+>H+。现将30g铁粉(过量)与44.0mL浓硫酸在加热条件下充分反应,共收集到11.2L(标准状况)气体,其质量为19.6g。
试计算: (1)浓硫酸的物质的量浓度; (2)反应后剩余铁粉的质量。
[思路探索] 若根据题供信息“有关物质及离子的氧化性顺序为:浓硫酸>Fe3+>H+”分析解题,那么应该根据氧化还原反应的“次序规律”分别考虑铁粉依次与浓硫酸、Fe3+、H+(即稀硫酸)的反应,其实,这是一条陷阱信息,只要抓住“铁粉过量”这一关键信息,便不难推知:最后的溶液中必定只有FeSO4这一种溶质。那么,综合运用“电子守恒”、“质量守恒”及“元素守恒”即可巧妙解答此题。
设参加反应的铁粉的物质的量为x,由题意知,混合气体的成分应为SO2、H2的混合气,物质的量总和为11.2L/22.4L·mol-1=0.5mol,则混合气体的平均摩尔质量为: 19.6g÷0.5mol=39.2g·mol-1
所以,混合气体中的SO2、H2体积比(即物质的量之比)为:37.2∶24.8=3∶2,即生成的SO2、H2的物质的量分别为0.3mol和0.2mol。
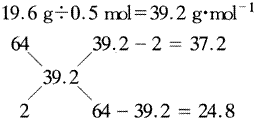
Fe-2e-——→Fe2+ H2SO4+2e-——→SO2 2H++2e-——→H2
根据电子守恒原理可得: 2x=0.3mol×2+0.2mol×2=1.0mol
解得:x=0.5mol
实际参加反应的铁粉质量为0.5mol×56g·mol-1=28g,由质量守恒原理知剩余铁粉质量为30g-28g=2g。
又由铁元素守恒知最后溶液中FeSO4的物质的量也应为0.5mol。
又据硫元素守恒知: n(H2SO4)=n(FeSO4)+n(SO2) =0.5mol+0.3mol=0.8mol
浓硫酸的物质的量浓度为: 0.8mol/0.044L=18.2mol·L-1
[思维拓展]
涉及铁元素及其化合物的计算题很多,解这类题时,建议解题者首先考虑“守恒”原理的应用,具备“守恒意识”是快速准确解答此类题的关键,因为大部分情况下,发生在溶液中的反应均具备上述诸种守恒关系。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。化学计算是化学学习中的重点,也是难点。中学化学常见的计算主要分为两个方面:①涉及...
Fe 3+ 有较强的氧化性,可以把铁粉氧化成 Fe 2+ : 2Fe 3+ +Fe=3Fe 2+ ① 这是铁离子...
在涉及金属铝及其化合物的计算中,有一类重要的计算,就是铝盐溶液与强碱溶液、偏铝酸...
1、何为过量? 如某反应中两种反应物的量都已给出,则应先通过计算判断两种反应物是否...
铁与稀硝酸的反应与反应物的量有关,原因在于金属铁有变价。具体情况比较复杂,归纳解...
一、问题的提出 将amolFe 3+ 、bmolCu 2+ 、cmolFe和dmolCu混合于同一反应体系(溶液...