
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.金属在元素周期表中的位置
到目前发现的110种元素来看,金属元素有88种,它们位于元素周期表的左下面,
2.金属的结构
金属元素的原子最外层电子数一般少于4个。最外层电子数越少,电子层数越多,金属元素的金属性越强,还原性也越强。
金属单质是金属晶体,金属晶体和合金中存在的化学键是金属键。金属键是由金属阳离子与自由电子间的相互作用所形成的一种化学键。金属原子最外层电子数越多、金属阳离子的电荷数越高,金属键就越强。
金属键可用来解释:① 金属的一些物理性质,如硬度、延展性、热和电的良导体等。② 铝的金属键比镁强,其硬度比镁大、熔点和沸点比镁高;但镁的金属活动性比铝强。③ 过渡金属的熔点和沸点比同周期左边的金属高,硬度大。
3.过渡元素
原子的结构特征
(1) 最外层只有1 ~ 2个电子;
(2) 增加的电子主要排列到次外层上。
原子半径
与主族相似,随核电荷数增加,原子半径从左到右依次减小,但比主族来得缓慢;从上到下,原子半径增大,但增加的辐度比主族小。
过渡元素具有较小的原子半径,次外层电子参与成键,金属键强度较大。 特点
(1) 全是金属。称为过渡金属。
(2) 大多数存在多种氧化态。
① 同一周期从左到右,氧化态逐渐升高,随后又逐渐降低。同一族中从上到下,高氧化态趋于比较稳定。
② 过渡元素呈低价态(+2、+3)是离子键,+4价以上,大多数是跟电负性大的氧或氟形成化合物或酸根,如V2O5、CrO3、Mn2O7、MOF6、WF6及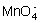 、
、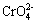 等,在这些分子或原子中以极性键相结合。
等,在这些分子或原子中以极性键相结合。
(3) 过渡元素的化合物往往带有颜色(水合离子、酸根)
Ti3+ | V2+ | V3+ | Cr3+ | Mn2+ | Fe2+ | Fe3+ | Co2+ | Ni2+ | Cu2+ |
紫红 | 紫 | 绿 | 蓝绿 | 肉色 | 浅绿 | 淡紫 | 粉红 | 绿 | 蓝 |
|
|
橙红 | 紫 |
阳离子最外层具有18电子结构的碱和碱性氧化物,一般呈白色或浅色,并且颜色随离子半径的增大而加深。具有不规则外电子壳结构的阳离子,它们的碱和碱性氧化物往往具有较深的颜色
Cu2O Ag2O ZnO CdO HgO Zn(OH)2 Cd(OH)2
红 棕 白 棕灰 红(或黄) 白 白
Cr2O3 Cr(OH)3 FeO Fe(OH)2
绿 灰蓝 黑 白
MnO Mn(OH)2 Fe2O3 Fe(OH)3
暗绿 白 红 红棕
NiO Ni(OH)2 CuO Cu (OH)2
暗绿 绿 黑 蓝
同种元素的氧化物的颜色,一般比氢氧化物深,高价氢氧化物的颜色一般比低价态的深。
酸性氧化物大部分是无色或白色的。常见的酸性氧化物中只有NO2呈红棕色,这跟它分子中电子总数是奇数有关。高价金属氧化物往往有颜色,如CrO3
(4) 容易形成络合物。
(5)① 很多金属的电极电势较小,因而可溶于酸;但是,有些“贵”金属的电极电势较正,所以它们难于与普通的非氧化性酸反应。
钪、钇和镧是过渡元素中最活泼的金属,在空气中能迅速氧化,与水反应放出氢气;也能溶于酸,性质接近碱土金属。其它过渡金属在通常情况下不与水反应,但一般可从稀酸中置换出氢。
② 过渡元素氧化物的酸碱性
过渡元素氧化物、氢氧化物或水合氧化物的碱性,从左到右逐渐减弱;在高氧化态时表现为从碱到酸。
Sc2O3 TiO2 CrO3 Mn2O7
(碱性) 两性 较强酸酐 (强酸)
同一族中各种元素自上而下,氧化态相同时酸性逐渐减弱,而碱性逐渐增强。
ⅢB M(OH)3是次强碱,Sr(OH)3为最弱。
Ti、Zr、Hf的氢氧化物 M(OH)4(或H2MO3)中,Ti(OH)4的碱性较差一些。
同一元素在高氧化态时酸性较强,随着氧化态的降低而酸性减弱。
MnO | Mn2O3 | MnO2 | MnO3 | Mn2O7 |
碱性 | 弱碱性 | 两性 | 酸性 | 酸性 |
锰的各种氧化态和特征
氧化态 | 水合离子 | 颜色 | 氧化物性质 |
+2 | Mn2+ | 浅粉红 | MnO,碱性,暗绿色,不溶于水 |
+3 | Mn3+ | 红 | Mn2O3,两性,棕黑色,不溶于水 |
+4 | 无 | MnO2,弱酸性,黑色,不溶于水 | |
+6 |
| 绿 | MnO3,酸性,(至今没有制得) |
+7 |
| 紫 | Mn2O7,酸性,不稳定 |
Mn(OH)2 Mn(OH)3 Mn(OH)4 H2MnO4 HMnO4
碱性增强,酸性增强, 氧化性增强,中间为两性氢氧化物。
4.金属通性
(1) 与非金属直接化合
F2、Cl2 能与所有金属反应( 包括Pt、Au ),Br2、I2、S与能除Pt、Au的其余金属反应,O2能与除Pt、Au、Ag的其余金属反应。
(2) 与水、酸和盐溶液的反应
K、Na + H2O —— MOH + H2↑
Ca + H2O —— Ca (OH)2 + H2↑
Mg Al + H2O —— Mg(OH)2 Al(OH)3 + H2↑
Zn + H2O —— ZnO Zn(OH)2 + H2↑
Fe + H2O —— Fe3O4 + H2↑
Zn + 2H+ —— Zn2++ H2↑
Fe + Cu2+—— Fe2++ Cu↓
Cu + 2Ag+ —— Cu2++ 2Ag↓
常温下,铝、铁遇浓硝酸和浓硫酸发生钝化。若金属与浓硝酸、浓硫酸(加热与否)发生反应,皆不产生氢气。
小结:
① 总是活动性大的金属原子失去电子变成金属阳离子,氢离子或活动性弱的金属阳离子接受电子还原成中性原子。(若是非金属原子,则得电子变成阴离子。)
② 金属单质参加的反应都是氧化还原反应,金属始终作还原剂。金属越活泼,还原性越强。
(3) 最高氧化物的水化物显碱性。
5.金属活动顺序表
6.金属冶炼的方法
金属的冶炼一般是指含有金属化合物的矿石里分离、提取的过程。金属冶炼的实质是使呈离子形式存在的金属获得电子,从它的化合物中还原出来。即“还原出金属”。
Mn+ + ne- = M
金属冶炼的方法与金属的活动性有关,也与它们存在的状态有关。极不活动的金属以游离态存在,用物理方法分离,大多数金属以化合态存在,要采用化学方法冶炼。
(1) 加热法:金属越不活动,它们的离子就越易结合电子。如Ag、Hg
2HgO ![]() 2Hg + O2↑
2Hg + O2↑
HgS (辰砂) + O2 ![]() Hg + SO2↑
Hg + SO2↑
(2) 还原剂法:轻金属之后,汞之前的金属。
根据金属的活动性和对提炼金属纯度的要求,可分为:
① 用C、CO作还原剂:金属氧化物的冶炼的重要方法是高温下用C还原,如
SnO2 (锡石) + 2C = Sn + 2CO↑
Cu2O (赤铜矿) + C = 2Cu + CO↑
一般重金属的碳酸盐先加热分解为氧化物,再还原,如
ZnCO3 (菱镁矿) ![]() ZnO + CO2↑
ZnO + CO2↑
ZnO + C = Zn + CO↑
硫化物矿是先煅烧成氧化物,再还原,如
2PbS (方铅矿) + 3O2 ![]() 2PbO + 2SO2↑
2PbO + 2SO2↑
2PbO + C = Pb +CO↑
炼铁用CO还原,
Fe2O3 +3CO = 2Fe + 3CO2↑
② 用H2作还原剂:可制很纯的金属,如W、MO、Ge,
WO3 + 3H2 = W + 3H2O
③ 用比较活动的金属作还原剂:常用还原剂为Al、Na、Mg、Ca,适用于高熔点及活动性较大的金属:Cr、Mn、V、Ti,如
Cr2O3 + 2Al = 2Cr + Al2O3
(3) 电解法:锌前金属。采用熔化电解。
MgCl2 ![]() Mg + Cl2↑
Mg + Cl2↑
2Al2O3 ![]() 4Al + 3O2↑
4Al + 3O2↑
小结:←————Zn←————————→Cu—————→Pt、Au
电解法 还原剂法 加热法 物理方法
7.金属离子的检验与分离
金属离子的检验方法:
(1) 焰色反应:K+、Li+、Na+、Ba2+、Ca2+、Sr2+、Cu2+;
(2) 有颜色的离子:Fe3+、Fe2+、Cu2+;
(3) Fe3+(及Fe2+)、Ag+、Ba2+的检验方法
(4) Zn、Cu、Ag的络合物
(5) Al、Zn的两性化合物
(6) 检验金属离子的H2S法:
ZnS白色,CuS、PbS黑色,Mns肉红色,CdS黄色,Sb2S3橙红色。
金属离子的分离:Fe2+、Cu2+:用氨水。Cu2+、Al3+:用强碱溶液。Fe2+、Al3+:用强碱溶液。Zn2+、Al3+:用氨水。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...