
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
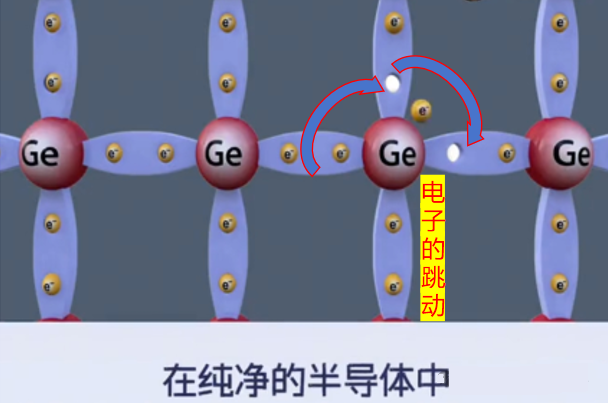
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子,对电子本身渴望所以要得电子,空穴(h+)可以看成具有氧化性。
一、化合物中氧空位的形成

二、例题应用
例题1:CeO2催化CO2与H2转化为的机理如图所示。反应体系中Ce呈现两种价态,催化剂中掺入少量CaO,用Ca2+替代CeO2结构中部分Ce4+形成CaxCe1-xO2,,可提高催化效率的原因是
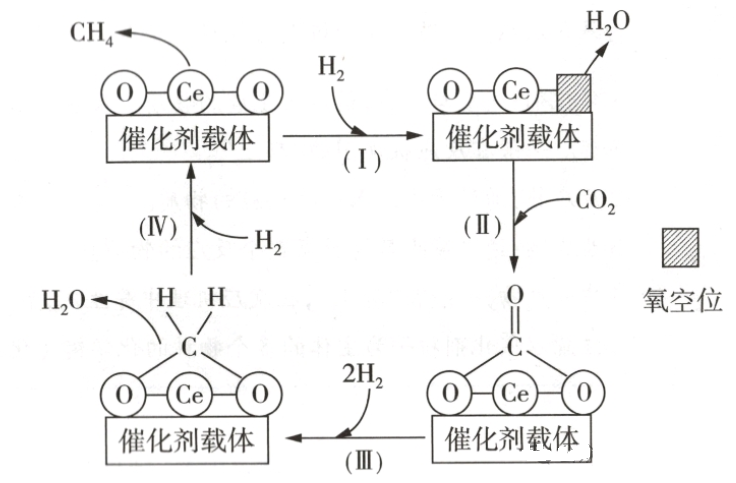
机理分析:
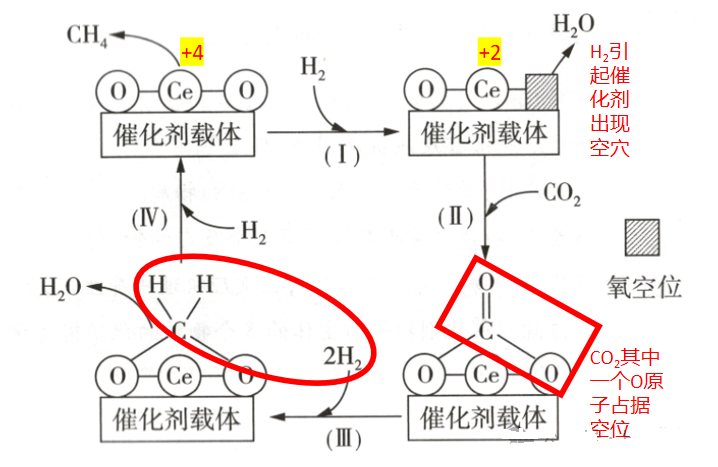
催化剂结构中出现较多的氧空位,利于二氧化碳的催化转化
例题2(2025·宁夏、陕西、山西、青海·八省联考卷)某团队合成了一种铁掺杂二氧化钛的新型催化剂,用于转化H2S为单质S,提出的催化历程示意图如下。NA是阿伏加德罗常数的值。下列说法正确的是( )
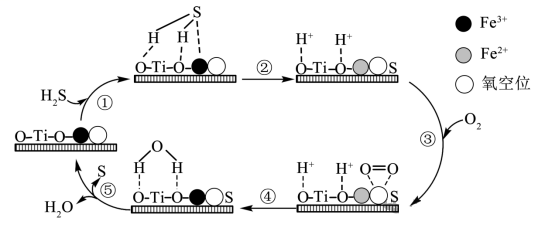
A.O2使Fe2+转化成Fe3+,恢复催化剂活性
B.过程①和④均发生了非极性键的断裂
C.过程②和③均发生了氧化还原反应
D.理论上,每转化34g H2S,转移的电子数目为NA
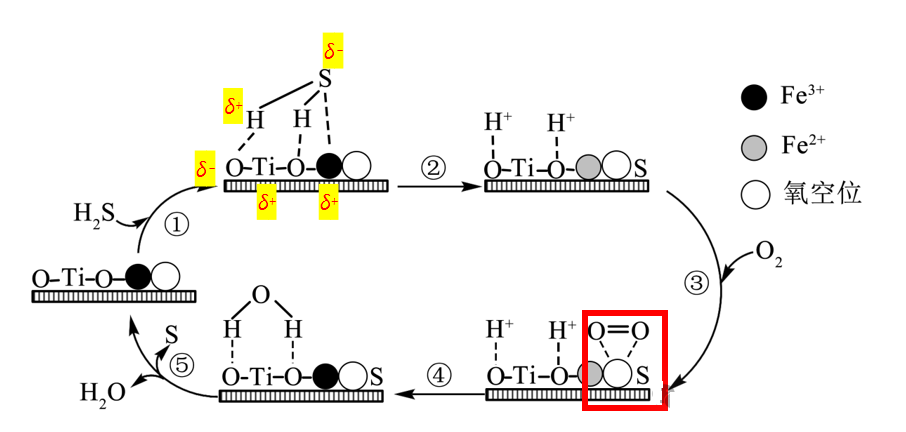
【分析】
A.根据图示③④两步历程,O2可Fe2+转化成Fe3+,恢复催化剂活性,A正确;
B.过程①中没有发生非极性键的断裂,过程④中发生了O=O非极性键的断裂,B错误;
C.过程②中铁元素化合价发生变化,发生氧化还原反应,过程③中元素化合价没有变化,没有发生氧化还原反应,C错误;
D.根据图示,该催化历程的总反应为2H2S+O2=2S+2H2O,可知H2S~2e-,理论上,公众号每转化34g H2S即1molH2S,转移的电子数目为2NA,D错误
例题3【2022全国乙卷】Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li+)和阳极反应(Li2O2+2H+=2Li++O2)对电池进行充电。下列叙述错误的是
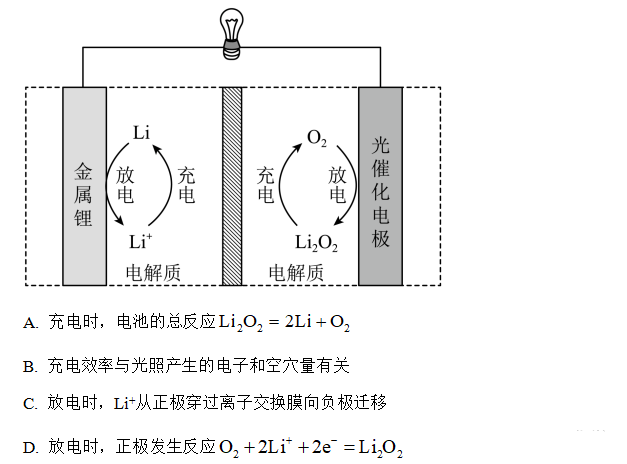
【分析】充电时光照光催化电极产生电子和空穴,驱动阴极反应(Li++e-=Li+)和阳极反应(Li2O2+2H+=2Li++O2),H+氧化O元素为O2;则充电时总反应为Li2O2=2Li+O2,结合图示,充电时金属Li电极为阴极,光催化电极为阳极;则放电时金属Li电极为负极,光催化电极为正极;据此作答。
【详解】A.光照时,光催化电极产生电子和空穴,驱动阴极反应和阳极反应对电池进行充电,结合阴极反应和阳极反应,充电时电池的总反应为Li2O2=2L i+O2,a正确;
B.充电时,光照光催化电极产生电子和空穴,阴极反应与电子有关,阳极反应与空穴有关,故充电效率与光照产生的电子和空穴量有关,b正确;
C.放电时,金属Li电极为负极,光催化电极为正极,Li+从负极穿过离子交换膜向正极迁移,C错误;
D.放电时总反应为2Li+O2=Li2O2,正极反应为O2+2Li++2e-=Li2O2,D正确;
答案选C。
例题4:光催化燃料电池(PFC)被认为是一种极具潜力的新能源技术,其工作原理如图所示(忽略溶液体积的变化)。光照时,光阳极会产生E和空穴h+,h+能直接将燃料氧化,e-则通过外电路的形式到阴极形成电流或者发生反应。
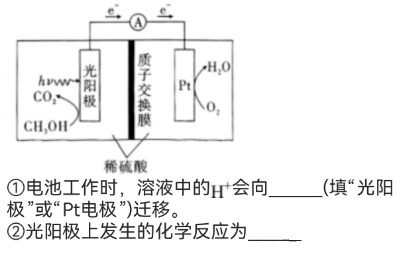
CH3OH +6H++ H2O = CO2 + 6H+
三【知识拓展】二氧化铅等材料的导电
二氧化铅(PbO₂)本身属于非整比化合物,其晶体结构中存在氧原子空位,导致电子可以在空穴间跳跃,形成导电性。
【空穴缺电子,可以看成易得电子】常用于铅蓄电池电极。
其他常见的非整比化合物
氧化亚铁(FeO)
在高温下(如1000°C)其组成会在FeO₁₋ₙ至Fe₂O₃之间波动,表现为非整比特性。
氧化锌(ZnO)
属于非整比化合物,常用于半导体材料。
氧化铜(Cu₂O)
同样为非整比化合物,具有半导体特性。
二氧化锐(YBa₂Cu₃O₇)
属于高温超导材料,其组成中的氧含量可能偏离整数比

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在高考化学电化学模块中,带离子交换膜的电化学装置是绝对高...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
【解析】: A.电解氧化的目的是在铝制品表面形成氧化膜,所以代...
并非所有放热反应都可以设计为原电池。能否设计为原电池的关...
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子...
一、天然冰晶石(NaAlF)的发现:18世纪的格陵兰矿物探索 天然...