
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【导读】MgO熔点为2852℃;Al₂O₃熔点为2050–2054℃。
在对比中发现MgO中Mg²⁺半径比Al³⁺半径大,离子晶体中,离子半径越小,离子间的距离越近,离子键越强;Al³⁺所带电荷数比Mg²⁺多,从电荷数看,Al₂O₃中离子键应更强,熔点应该更高,而事实恰恰相反。
首先主导因素是离子键百分数,MgO的离子键含量更高;然后电负性差值对离子键有强化作用,MgO中Mg和O电负性差值更大,离子性更强;最后离子半径越小,极化作用增强,维持离子键主导,Al₂O₃刚好符合这一特征。氧化镁作为氧化铝陶瓷的烧结助剂时,可通过形成低熔点液相促进致密化,此现象与熔点本身的比较无关。
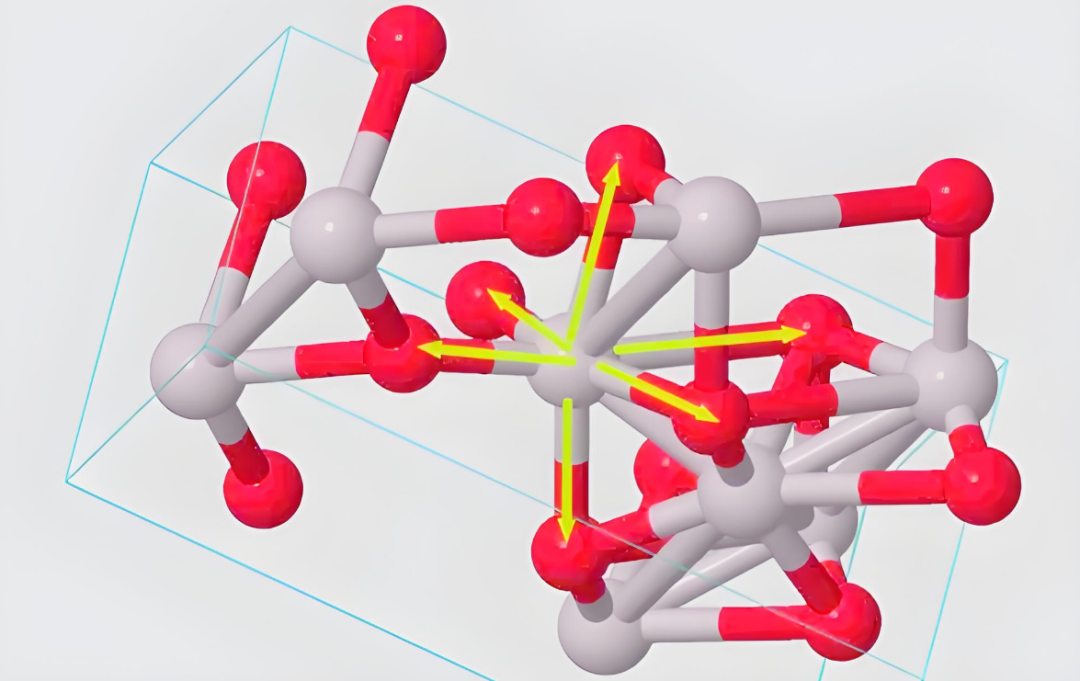
1. 离子性百分数的差异
离子性越高,化合物中离子键占比越大,晶格能越高,熔点随之升高。氧化镁的离子性百分数为50%,而氧化铝为41%。

2. 离子电荷与半径的综合作用
Mg²⁺的电荷(+2)低于Al³⁺(+3),Mg²⁺的离子半径(0.72Å)显著大于Al³⁺(0.54Å)。Al³⁺电荷更高,但较小的半径导致其与O²⁻的极化作用更强,削弱离子键占比,增强共价性,离子键仍为主,但共价成分增加导致熔点下降。此外Al₂O₃离子间距离相对较小,但因共价性增加,实际晶格能可能低于预期,导致熔点较低。
3. 电负性差异影响离子键强度
电负性差越大,离子性越强,熔沸点越高。Mg(1.31)与O(3.5)的电负性差(Δ=2.19),这大于Al(1.61)与O(3.5)的差值(Δ=1.89)。
4. 晶格结构与共价键的干扰
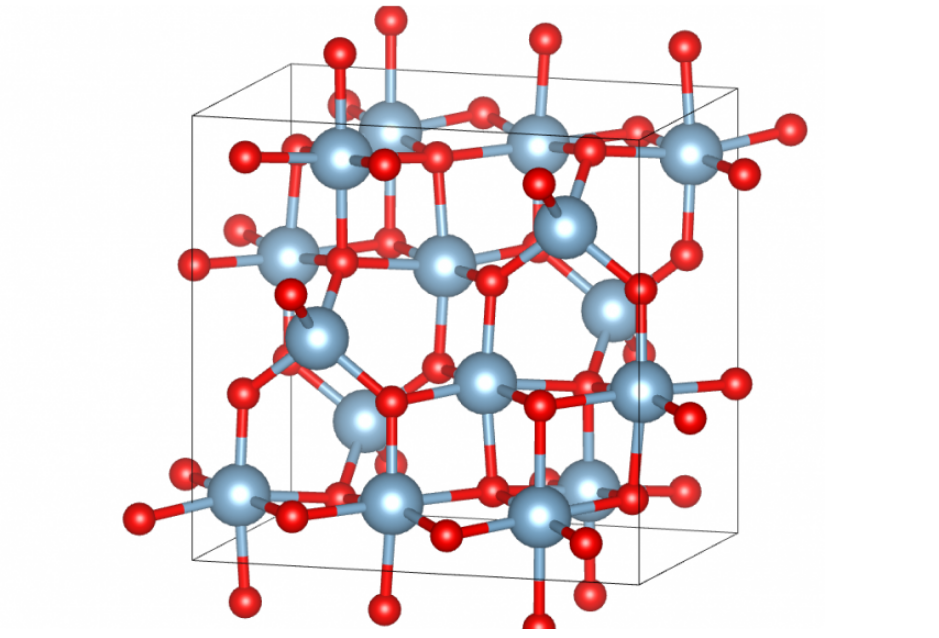
MgO为面心立方晶格(每个Mg²⁺被6个O²⁻包围),结构对称性高,离子键主导。氧化铝中如β-Al₂O₃为六方最密堆积晶格(每个Al³⁺被6个O²⁻包围),但Al³⁺的强极化作用导致共价键成分增加,削弱离子键强度。
这种结构差异导致氧化镁的晶体结构更加规整、紧密,离子间的相互作用更加稳定,从而具有更高的熔点。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。我们从高中化学的角度来认识一下离子液体。想象一下,如果食盐(氯化钠)在室温下不是...
导语:想象一下,我们把原子看成是搭建豪宅(晶胞)的积木。当这些“原子积木”紧密堆...
离子液体(Ionic Liquids, ILs)是完全由离子构成、在室温或接近室温(通常≤100℃)...
在晶体分类体系中,除了分子晶体、共价晶体、金属晶体、离子晶体这四大基础类型外,还...
【导读】水溶液中Cu(II)比Cu(I)更稳定,这看似与电子排布3d比3d更稳定的直觉相悖,但...
【导读】 不是,差别很大。 晶格能 和离子键键能这两个概念都描述“ 把离子晶体拆成离...