
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、钠的燃烧
1、实验图示的常考变换
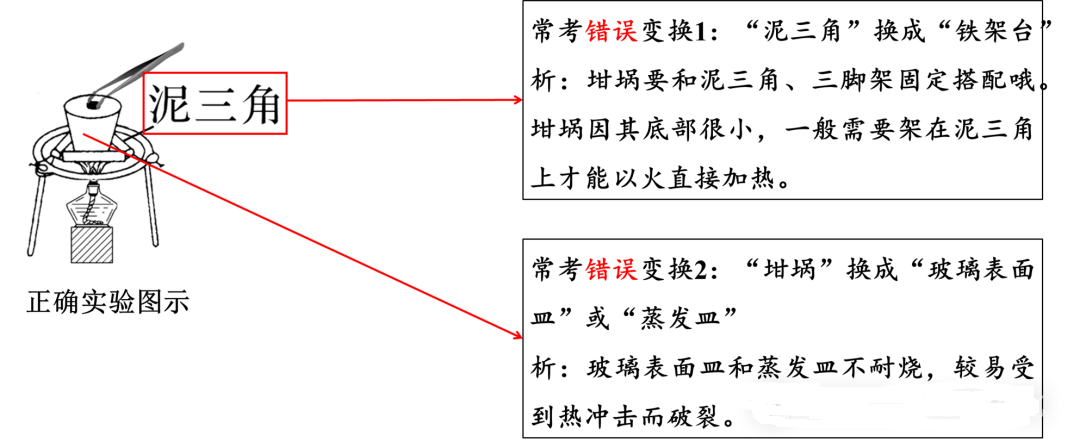
2、相关对应习题
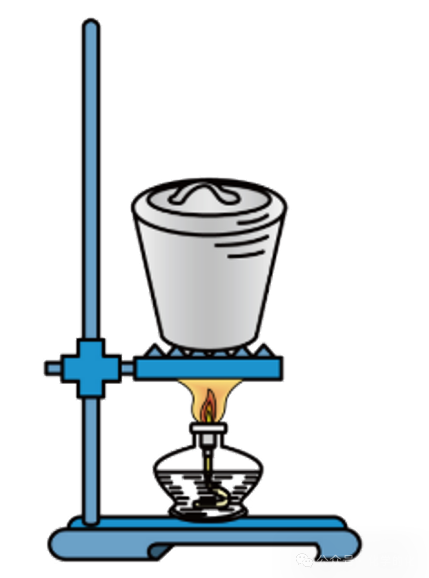
错误变换1: “泥三角”换成“铁架台”
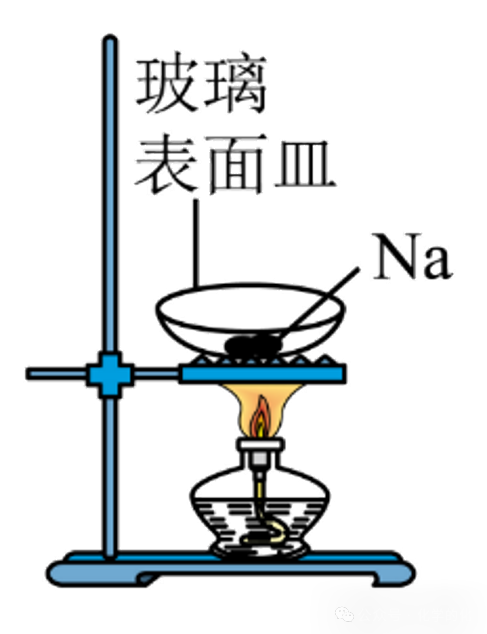
错误变换2:“坩埚”换成“玻璃表面皿”或“蒸发皿”
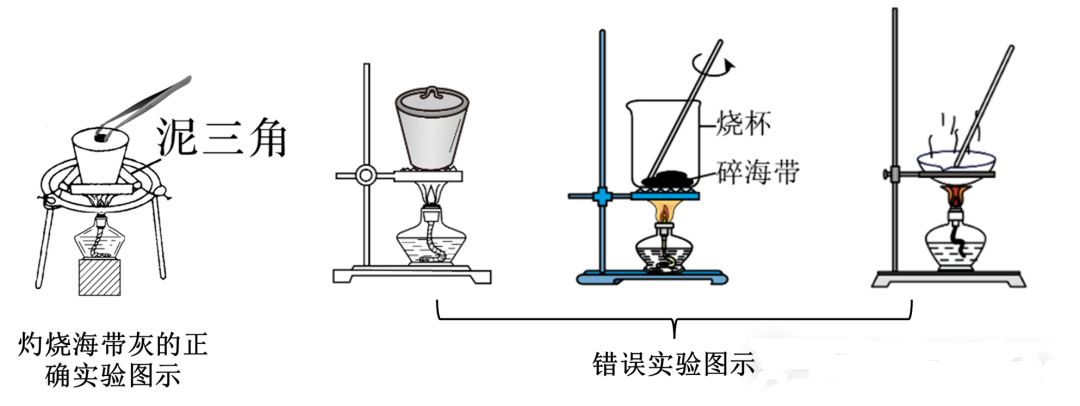
引申实验:
a.海带灰的灼烧(常考引申)
b.锂、钾的燃烧(金属性的比较);碳酸钠固体中碳酸氢钠固体的去除;物质的熔化(物质导电性实验);硫酸铜晶体里结晶水含量的测定、热重分析(2021年全国卷)等
(1)注意锂和氧气加热只生成氧化锂,钠和氧气加热生成过氧化钠;
(2)加热熔化NaOH、过氧化钠、碳酸钠测定导电性时不能用瓷坩埚、石英坩埚和氧化铝坩埚,因为NaOH、过氧化钠、碳酸钠和二氧化硅、氧化铝会发生反应。
3、其他实验细节
(1)取金属钠时应用镊子,不能用手直接接触,一般取绿豆大小即可,不能太大,以免实验时发生危险。
(2)不要近距离俯视坩埚!
(3)待钠熔化后立即撤掉酒精灯,观察现象。
(4)钠通常保存在煤油中,防止与氧气、水等反应。
(5)未用完的钠必须放回原试剂瓶。
二、钠与水反应
1、钠与水反应的实验现象解释
观察烧杯中钠与水反应的实验现象时,不能近距离俯视
①热效应的判断(是否可以用下列装置判断钠与水的反应是放热反应?)
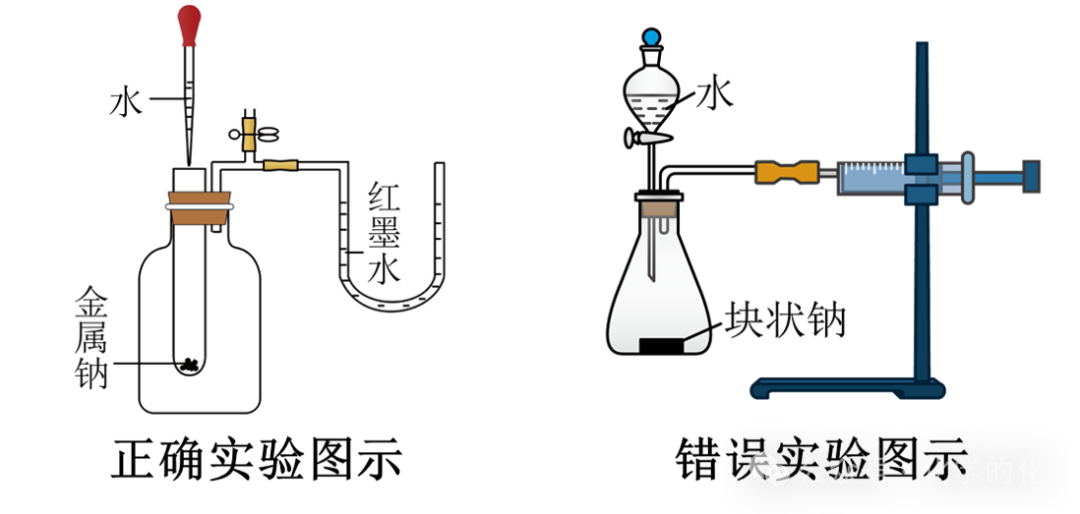
右侧图示中,Na与H2O反应有H2生成,也会使得注射器活塞向右移动;气密性良好的情况下,水的滴入也会导致活塞向右移动,所以不能验证钠与水反应放热。
②密度的分析:钠浮在水面上,说明钠的密度比水小。
引申判断:
a.钠、水、煤油的密度
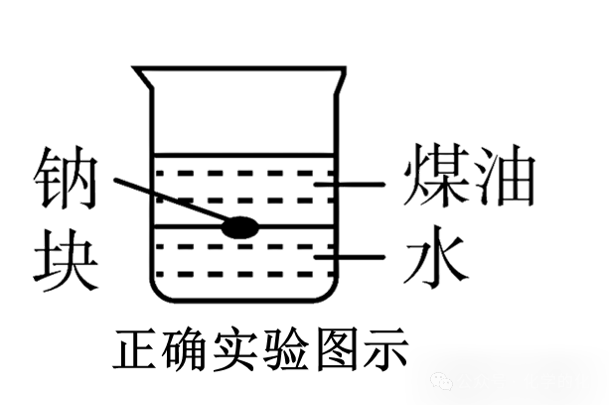
由图可知,钠在水与煤油液面中间,则可知钠的密度比水的小,比煤油的大。
b.钠、水、乙醇的密度

钠的密度比乙醇的大,会先沉在试管底部。随后钠会浮起来,这是因为钠表面的氢气产生了浮力。最后钠会逐渐消失,反应终止。
③熔点的分析:钠熔化成小球,说明反应放热,且钠的熔点低。
④产物NaOH的检验:滴加酚酞,溶液变红。
⑤产物氢气的检验与收集:
排水法收集氢气:
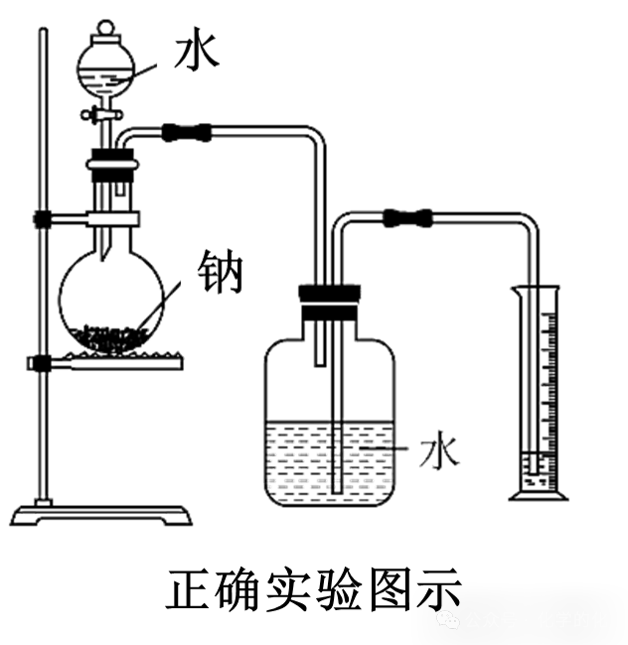
点燃法检验氢气:(要先验纯)
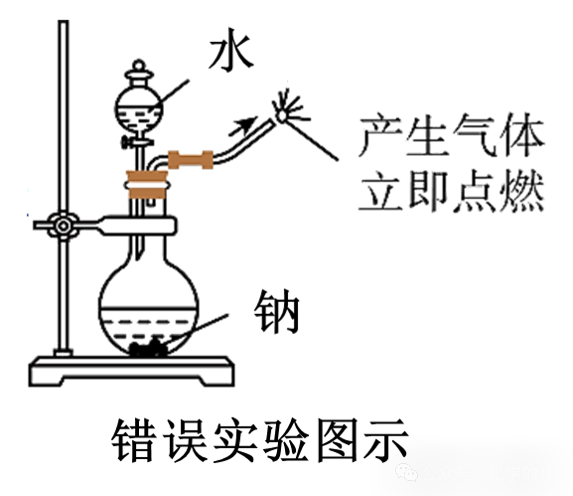
引申判断:如何检验钠与乙醇反应产生的氢气?
同样需要先验纯才能点燃哦!(旁边错误图示就没有验纯)
按照正确图示进行操作,我们会观察到烧杯内壁有水雾生成,加入澄清石灰水以后,溶液不变浑浊(“不变浑浊”说明点燃气体中没有乙醇,进一步说明烧杯内壁的水雾是氢气燃烧产生的,而不是乙醇燃烧产生的)。
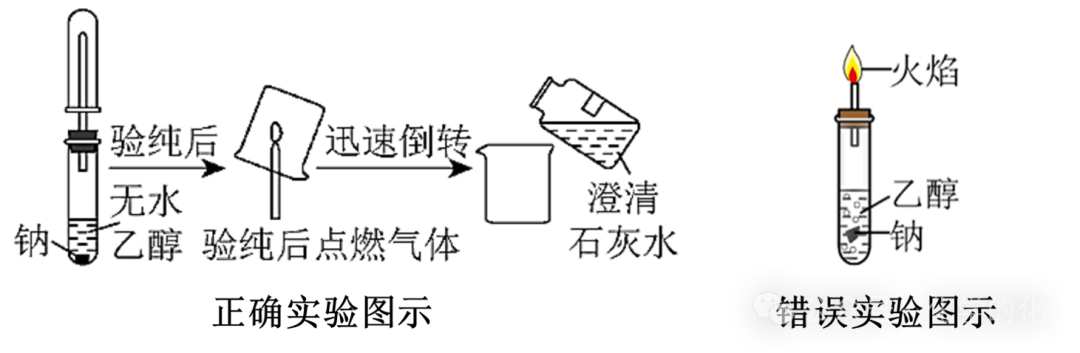
友情提醒:错误图示中的黄色火焰是没有问题的,因为使用了玻璃尖嘴导管(玻璃里含有钠元素),因此点燃氢气并不能产生淡蓝色的火焰,而是火焰呈黄色。
2、羟基中氢原子活性的比较
①乙醇、乙酸、苯酚、水与钠反应速率大小比较?
与钠反应时速率:乙酸>苯酚>水>乙醇
羟基中氢原子的活性(H-O的极性):乙酸>苯酚>水>乙醇
原因:
![]()
(1)乙醇中的乙基具有推电子效应,导致羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
(2)苯酚中羟基的氧原子提供电子和苯基形成了p-Π共轭,导致H-O的电子云密度降低,更易断裂,活性强;另外,苯基具有吸电子效应,导致羟基的极性比水分子中的大,因而钠和苯酚的反应比钠和水的更剧烈。
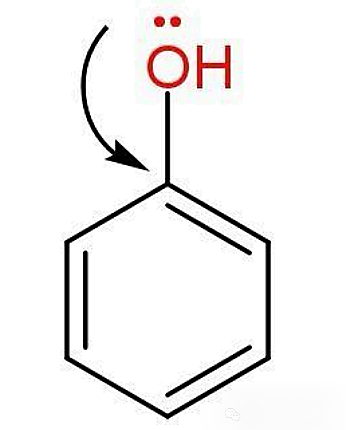
(3)乙酸中羰基存在着更强的吸电子效应,所以,分子中H-O的极性比苯酚强,与水反应时比苯酚更剧烈。
②一氯乙酸、二氯乙酸、三氯乙酸与钠反应速率大小比较?
与钠反应时速率:三氯乙酸>二氯乙酸>一氯乙酸
羟基中氢原子的活性(H-O的极性):三氯乙酸>二氯乙酸>一氯乙酸
原因:
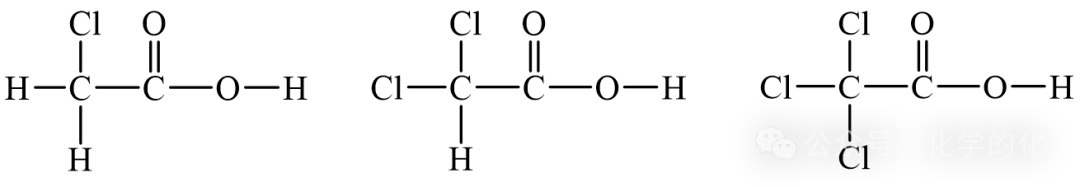
氯原子越多,吸电子效应越强,H-O极性越强,反应速率越快。
3、金属活动性的比较
将相同大小的钠块和钙块放入相同体积的蒸馏水中,钙与水反应不如钠剧烈。能否说明金属活动性:Na>Ca?
答案:×
解析:钙与水反应生成氢氧化钙和氢气,微溶的氢氧化钙附着在钙的表面阻碍反应的继续进行,所以将相同大小的钠块和钙块放入相同体积的蒸馏水中,钙与水反应不如钠剧烈不能说明钠的金属活动性强于钙
延申实验:(相同原理)
(2024年12月 T8省联考)
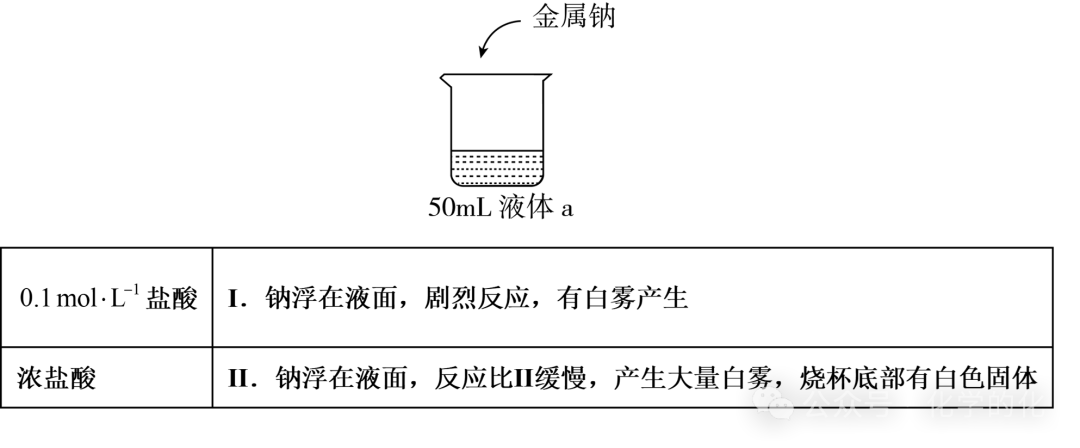
反应Ⅱ中盐酸浓度更高,但速率更慢:
反应生成了白色固体NaCl附着在钠的表面阻碍反应的继续进行
4、与盐溶液的反应
①钠与盐溶液反应时一般先考虑与水的反应,生成的NaOH与盐可能发生复分解反应。
②注意处于饱和状态的溶液,加钠反应以后会有固体析出,例如饱和食盐水中加钠:只发生钠与水的反应,但是消耗水以后会导致原饱和溶液变为过饱和,从而析出白色固体。
③引申实验:氢氧化亚铁的制备
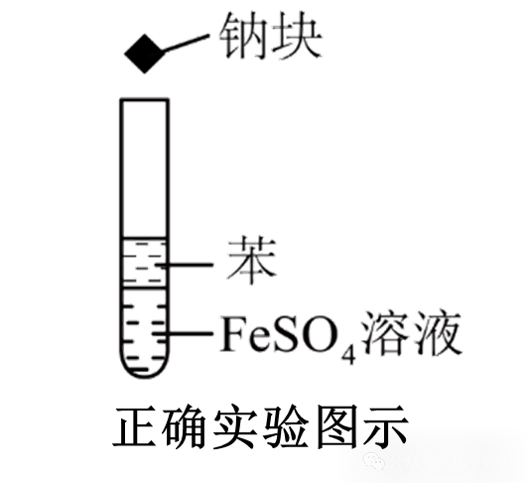
钠与水反应生成的NaOH与硫酸亚铁发生复分解反应生成氢氧化亚铁。
5、其他实验细节
1.钠与水反应时,烧杯中的水不宜装得太满。
2.实验剩余的钠应放回原试剂瓶。
3.切绿豆大小的钠,太大了会造成实验危险。
4.实验图标:
5.借助该实验,需认识到钠着火不能用水扑灭,应该用沙土扑灭。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。实验图示的常考变换 大π键又叫离域π键,何谓“离域”,顾名思义,“离域”就是指离...
一、过氧化钠与水反应制取氧气的实验装置选择 过氧化钠是粉末状固体,会从右侧两个装...
实验图示的常考变换分析 1.正确操作流程: 2.实验图示: 02 示例分析 1.错误实验图示1...
首先切去一块绿豆大小的金属钠,擦干表面的煤油,除去氧化膜,至于表面皿上(昨天做乙...
金属钠如何制备? 答: 1、戴维法: 戴维是通过电解法首先制得的金属钠,随后几十年内,...
长时间放在煤油中的钠表面的黄色物质是什么? 由于金属钠很活泼,实验室里通常把它放在...