
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
水的“浓度”需要根据具体的使用情况来理解,具体有如下几种情况:
第一:若按液态纯水的物质的量浓度计算,约为55.56M。
第二:若指水中H+或OH−的浓度(25℃),则为1.0×10⁻⁷M。
第三:在化学反应中,水的浓度通常视为恒定,不显式参与平衡表达式。
第四:若溶质浓度较高,水的浓度会因溶质占据体积而降低。
1.纯水的摩尔浓度(作为液态纯物质)
计算方式: 纯水的密度约为1g/mL(25℃时),即1000g/L。 水的摩尔质量为18g/mol,因此其摩尔浓度为:
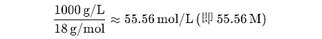
注意:液态纯物质的浓度在化学平衡中通常被视为常数(活度为1),因此在反应式中不显式写出其浓度(例如:水的电离平衡常数Kw中不包含[H2O])。
2.水的自离解产生的离子浓度(H⁺和OH⁻)
在25℃时,水的离子积常数为:
Kw=[H+][OH−]=1.0×10−14
因此纯水中:[H+]=[OH−]=1.0×10−7mol/L
温度影响:Kw随温度升高而增大(例如:100℃时Kw≈1.0×10−12),因此温度升高,[H+]和[OH−]的浓度会升高。
3.水作为溶剂的“浓度”在化学反应中的意义
当水作为溶剂时(例如在酸碱反应中),其浓度通常被视为恒定值(约55.56m),因此在平衡常数表达式中不显式出现。
例如:水的电离反应H2O⇌H++OH−的平衡常数写作:Kw=[H+][OH−] ,
而非K=([H+][OH−])/[H2O],因为[H2O]已被纳入常数Kw中。
4.常见误解表述纠偏
①“水的浓度”一词不常适用于纯水:浓度一般描述溶质在溶液中的含量,而纯水作为溶剂时,更准确的表述是“水的密度”或“水的活度”。
②在稀溶液中:若溶质含量极少(如极稀的溶液),水的浓度仍接近55.56M;若溶质浓度较高,水的浓度会因溶质占据体积而降低。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由...