
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、原子结构与元素周期表
1、元素周期律、元素周期系和元素周期表
(1)元素性质随着原子序数递增发生周期性的重复,这一规律被称作元素周期律。
原子序数:按相对原子质量(后来改为核电荷数)从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。
1913年,英国物理学家莫塞莱证明了原子序数不是相对原子质量,而是核电荷数。
(2)元素周期系:元素按原子核电荷数递增排列的序列称为元素周期系。
(3)元素周期表:呈现元素周期系的表格。
元素周期系只有一个,元素周期表有多种。
门捷列夫元素周期表:
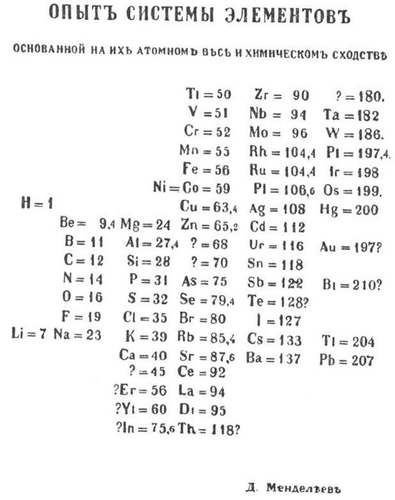
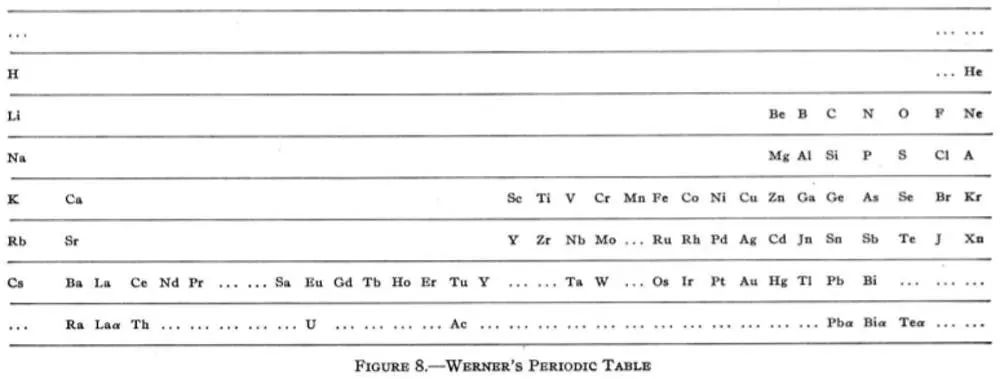
维尔纳元素周期表:
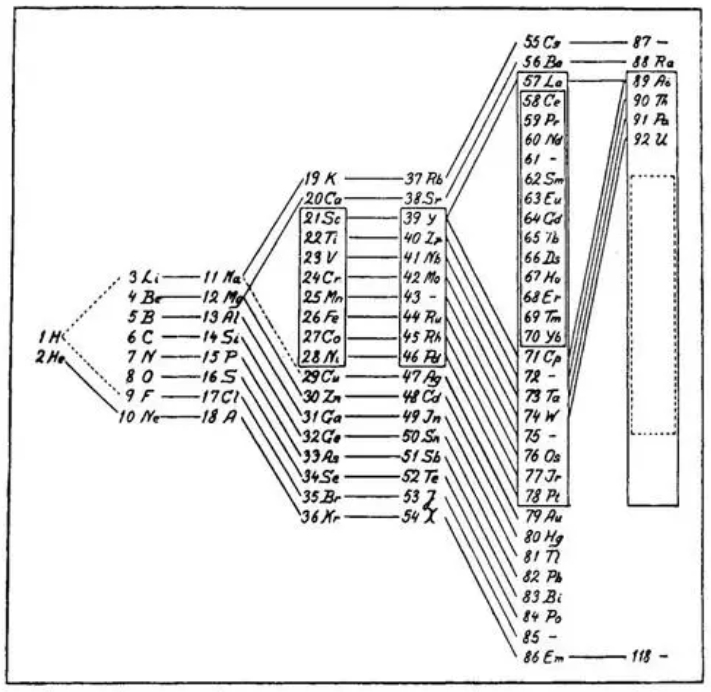
玻尔元素周期表:
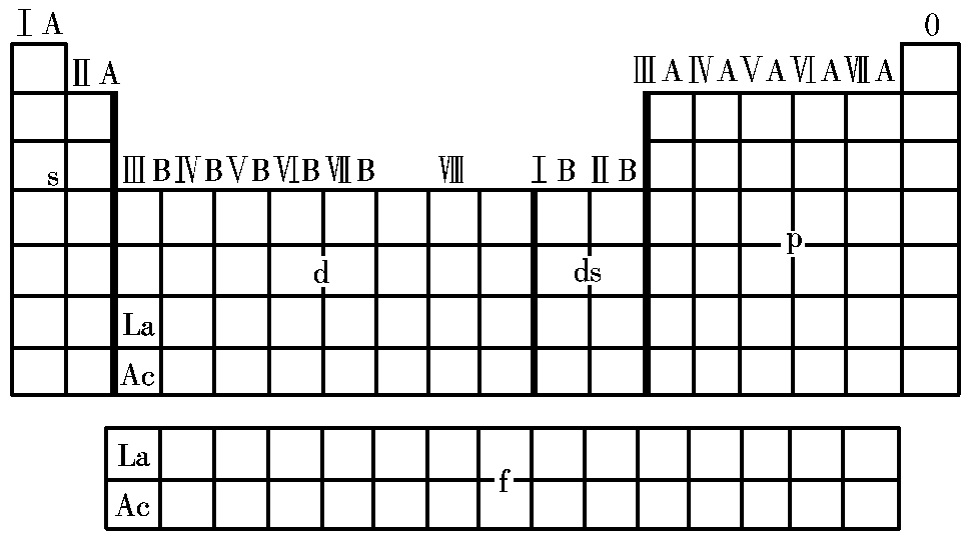
2、构造原理和元素周期表
元素周期表用能级进行分区,又可以分为s区、p区、d区、ds区、f区,如下图所示
3、对角线规则
在元素周期表中,某些主族元素与右下角的主族元素的有些性质是相似的,这种相似性被称为对角线规则。

(1)锂与镁的相似性
锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物。
锂、镁都能与氮气直接化合而生成氮化物。
锂、镁的氟化物、碳酸盐、磷酸盐均难溶于水。
锂、镁的碳酸盐在加热时均能分解为相应的氧化物和二氧化碳。
锂、镁的氯化物均能溶于有机溶剂中,表现出一定的共价性。
值得注意的是,锂的金属性比镁强,氢氧化锂为强碱,氢氧化镁为中强碱;锂与水反应平缓不剧烈,镁则很缓慢;氢氧化锂易溶,氢氧化镁难溶。
(2)铍与铝的相似性
铍、铝都是两性金属。既能溶于酸,也能溶于强碱。
铍和铝都能被冷的浓硝酸钝化。
铍和铝的氧化物均是熔点高、硬度大的物质。
铍和铝的氧化物,氢氧化物都呈两性,而且氢氧化物都难溶于水。
铍和铝的氟化物都能与碱金属的氟化物形成配合物,如Na2[BeF4],Na3[AlF6]。它们的氯化物、溴化物、碘化物都易溶于水。氯化物都是共价型化合物,气态下易生成双聚体,易升华,易聚合,易溶于有机溶剂。
(3)硼与硅的相似性
两者在单质状态下都有显著的金属性。
自然界中多以氧化物形式存在,B-O和Si-O十分稳定。
氢化物多种多样,是共价型化合物。
氧化物的水化物是弱酸。
二、元素周期律
1、原子半径
原子半径的大小取决于两个因素:一个是能层数,一个是核电荷数。
能层数越多,电子之间的排斥力越大,原子半径越大。
核电荷数越大,核对电子的吸引力越大,原子半径越小。
下面是主族元素的原子半径:
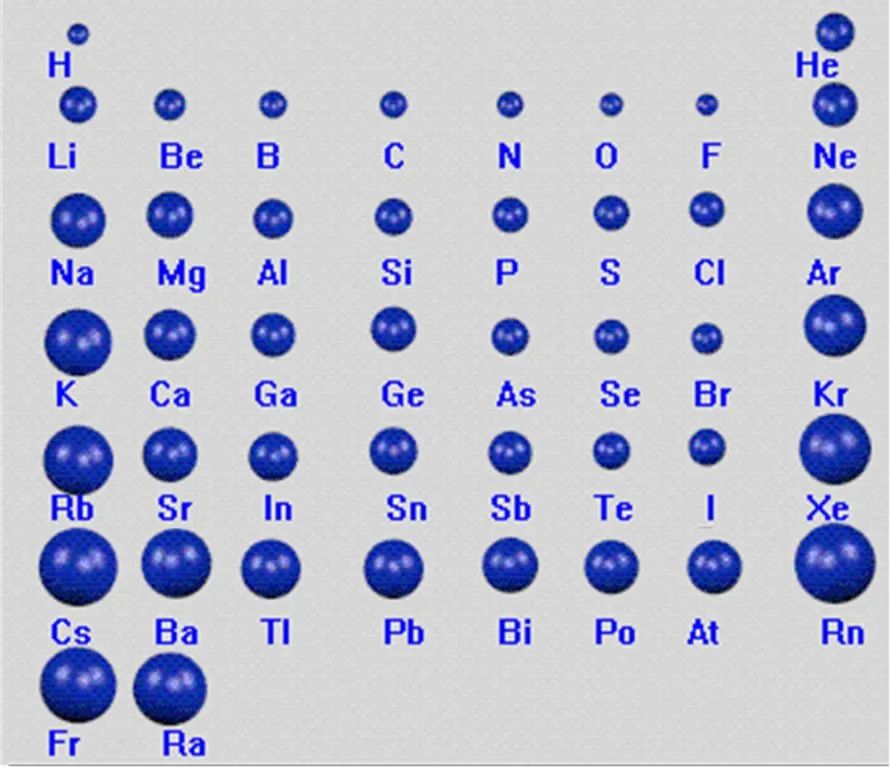
从图中可以看出,同一主族从上到下,能层越多,原子半径越大。同一周期除稀有气体元素外,从左到右,核电荷数越大,原子半径越小。
2、电离能
(1)什么是电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量,单位一般是kJ·mol-1。
M (g)→M+ (g)
第一电离能:气态电中性基态原子电离出一个电子转化为气态基态正一价阳离子的电离能。
第二电离能:气态基态正一价阳离子电离出一个电子转化为气态基态正二价阳离子的电离能。
依次类推第三电离能、第四电离能…
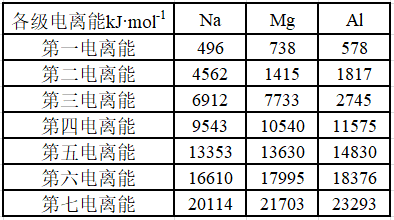
思考:
①同一元素的电离能为什么越来越大?
②为什么Na在第一电离能和第二电离能之间变化很大,而Mg在第二电离能和第三电离能之间变化很大,Al在第三电离能和第四电离能之间变化很大?
(2)第一电离能在周期和主族中的变化规律
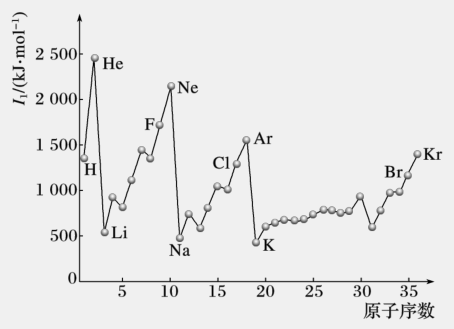
①对于同一主族而言,随着原子半径增大,原子核对最外层电子的吸引作用减小,第一电离能减小。
②对于同一周期而言,一般来说,随着原子序数增大和原子半径的减小,原子核对最外层电子的吸引作用增大,第一电离能增大。
但同一周期的IIA元素与IIIA元素相比,由于IIA元素的s能级处于全充满状态,能量较低,电子较稳定,第一电离能偏高,使IIA元素的第一电离能高于IIIA元素的第一电离能。
同一周期的VA元素与VIA元素相比,由于VA元素的p能级处于半充满状态,能量较低,电子较稳定,第一电离能偏高,使VA元素的第一电离能高于VIA元素的第一电离能。
3、电负性

美国化学家鲍林提出电负性
(1)键合电子:原子中用于形成化学键的电子。
(2)电负性用来描述不同元素的原子对键合电子吸引力的大小。
电负性越大,原子对键合电子的吸引力越大。
以F的电负性为4.0,Li的电负性为1.0作为相对标准,得到各元素的电负性。
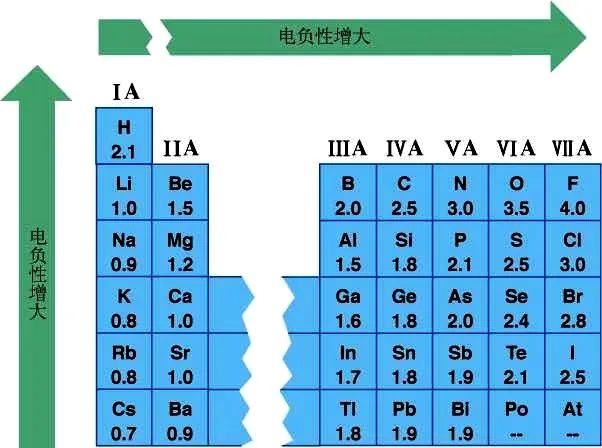
(3)电负性的功能:
电负性的大小可以作为判断金属性和非金属性强弱的依据,金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,电负性为1.8左右的元素既有金属性,又有非金属性。
电负性差量大于1.7的两种元素的原子易形成离子键,小于1.7的易形成共价键。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...