
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、预处理
1、研磨、粉碎、喷洒、雾化:将块状或颗粒状的物质磨成粉末或将液体雾化,增大反应物的接触面积,以加快反应速率或使反应更充分,以提高原料转化率、利用率、浸取率,提高产品的产率等目的
2、增大接触面积:固体——粉碎、研磨;液体——喷洒;气体——用多孔分散器等
3、浸出(即浸取/溶解):向固体中加入适量溶剂,使其中可溶性的物质溶解或反应进入溶液。包括水浸、酸浸、碱浸、醇浸等
(1)水浸:与水接触反应或溶解,使原料变成离子进入溶液中
(2)酸浸:通常用酸溶解、去氧化物(膜),使得可溶性的离子进入溶液中;抑制某些金属离子的水解;除去杂质离子等
(3)碱浸:除去油污(酯)/碱煮;去铝片氧化膜;溶解铝、二氧化硅;调节pH、促进水解(沉淀)
(4)醇浸:提取有机物,常采用有机溶剂(乙醚,二氯甲烷等)浸取的方法提取有机物
(5)有机溶剂浸:溶解有机物,去油污
4、浸出率(浸取率):实际浸取量与理论浸取量的比值 (固体溶解后,离子在溶液中含量的多少)
5、提高浸出率的方法:适当升温(加热)、搅拌、粉碎(研磨)、增大反应物(酸、碱)的浓度
6、灼烧(焙烧、煅烧)
(1)改变结构和组成,使一些物质能溶解;
(2)并使一些杂质在高温下氧化、分解
(3)其他矿石转化为氧化物
(4)去除有机物
(5)除去热不稳定杂质
二、常见的操作与答题方法
1、调pH除杂:控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀;抑制某些离子的水解;防止某些离子的氧化等
(1)目的与答题规范表述:
①分步沉淀:中和/消耗H+/OH-,调节pH,使××生成××沉淀(过滤分离)
②pH过小/过大时,无法生成××,降低××产率/效率
③(蒸发/结晶前)调节pH××(强酸性),防止/抑制××水解
(2)调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH值增大;
②不引入新杂质
2、蒸发结晶:提取溶解度随温度变化不大的溶质,如:NaCl
3、蒸发结晶的标志:当有大量晶体出现时,停止加热,利用余热蒸干
4、冷却结晶:提取溶解度随温度变化较大的物质、易水解的物质或结晶水化合物。如:
![]()
5、蒸发浓缩的标志:当有少量晶体(晶膜)出现时
6、重结晶(冷却结晶):
将晶体溶于溶剂,又重新从溶液中结晶的过程
(1)原理:利用混合物(一般为两种物质混合)中各组分在某溶剂中溶解度不同,或在同一溶剂中不同温度时溶解度不同而使它们相互分离
(2)随温度变化,溶解度变化不同,通常为:溶质随温度升高,溶解度变化大,杂质随温度升高,溶解度变化小,杂质可能在溶剂中溶解度大/小
(3)从溶液中得到干燥晶体或沉淀的步骤:
①若溶质溶解度大,且温度升高,溶解度变化大(一般变大),采用:蒸发浓缩,冷却结晶,过滤、洗涤、干燥
②若溶质溶解度大,且温度升高,溶解度变化小,采用:蒸发结晶,趁热过滤、洗涤、干燥
③若杂质溶解度非常小,要使杂质在趁热过滤时被滤去留滤纸上
④若杂质溶解度非常大,过滤/趁热过滤时被滤去留在母液中
(4)实例说明:
①NaCl (KNO3):蒸发结晶,趁热过滤、洗涤、干燥 (杂质留在母液中) (溶质溶解度大,且温度升高,溶解度变化小)
②KNO3(NaCl):蒸发浓缩,冷却结晶,过滤、洗涤、干燥 (杂质留在母液中) (溶质溶解度大,且温度升高,溶解度变化大)
③苯甲酸的重结晶:蒸发浓缩,趁热过滤,冷却结晶,过滤 (杂质留在滤纸) (杂质溶解度非常小)
④Ca(OH)2型:蒸发、结晶(溶解度小,且温度升高溶解度变小)
7、趁热过滤:
防止过滤一种晶体或杂质的过程中,因降温而析出另一种晶体
(1)要滤渣(产品):防止降温时析出杂质而影响产品纯度或减少产品溶解损耗
(2)要滤液(产品):防止降温时析出产品(溶解度随温度增大而增大)而损耗(除去溶解度小或难溶的杂质)
(3)趁热过滤后,有时先往滤液中加入少量水,加热至沸,然后再冷却结晶的原因:稀释溶液,防止降温过程中××析出,提高产品的纯度
8、晶体干燥的方法:
自然晾干、滤纸吸干、在干燥器中干燥、烘干(热稳定性较好),低温减压干燥(热稳定性差)
9、在过滤操作后,有时需要滤渣,舍弃滤液;有时需要滤液,舍弃滤渣
(1)需要滤液时,如何提取母液中的成分
案例1:在粗盐的提纯实验中,过滤,舍去不溶性杂质(滤渣)后,怎样从母液中获取NaCl固体?
加热蒸发,当析出大量NaCl晶体时,停止加热,利用余热蒸干
案例2:若母液是CuSO4溶液,怎样获得CuSO4·5H2O晶体?
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
(2)需要滤渣时,如何得到纯净的滤渣
案例1、在测定Na2SO4和NaCl的混合物中Na2SO4的质量分数时,可以在混合物中加入过量BaCl2溶液,沉淀SO42-,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问:
①怎样判断SO42-是否沉淀完全?(离子已除尽的方法):
静置,取少量上层清液于试管中,继续加入BaCl2溶液,若无白色沉淀产生,则证明SO42-已沉淀完全(或离子已除尽)
②过滤完毕后,洗涤沉淀(即洗涤沉淀的目的):
洗去晶体表面吸附的可溶性的杂质离子 (Na+、Cl-等)
③沉淀的洗涤方法:
沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复实验2~3次
④怎样判断沉淀是否洗净:
取最后一次洗涤液少量于试管中,加入稀HNO3酸化的AgNO3溶液,若无白色沉淀产生,则证明沉淀已洗净
(3)加入沉淀剂不能过量的原因:防止××沉淀溶解造成损失,降低产率
(4)加入过量沉淀剂的原因:使充分沉淀,提高产品纯度
10、特定试剂洗涤晶体
(1)“冰水洗涤”:既能洗去晶体表面的杂质离子,且能防止晶体在洗涤过程中的溶解损耗
(2)有机溶剂(乙醇、丙醇):既能洗去晶体表面的杂质离子,且能防止晶体在洗涤过程中的溶解损耗,乙醇易挥发,使晶体快速干燥
11、滴定终点的判断:
用标准盐酸滴定未知浓度的氢氧化钠溶液,酚酞作指示剂,滴定终点的判断:当加入最后一滴标准盐酸后,溶液由红色变为无色,且半分钟内不褪色
三、循环物质确定定和副产品的判断
1、循环物质的确定

2、副产品的判断
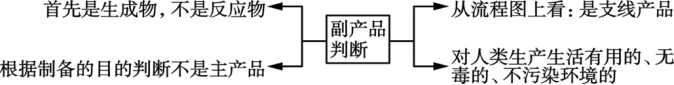
3、滤渣、滤液成分的确定:要考虑样品中原料和杂质中的每一种成分在每一步与每一种试剂的反应情况:
(1)哪些物质(离子)消失了
(2)所加试剂是否过量或离子间发生化学反应又产生了哪些新离子;再考虑这些离子间是否会发生反应
(3)去除主产品和副产品,原料中的相关成分存在于何处
四、控制反应条件
1、控制体系的温度
(1)温度的作用
①防止副反应的发生
②使化学平衡移动;控制化学反应的方向
③控制固体的溶解与结晶(如趁热过滤能防止某物质降温时析出)
④控制反应速率;使催化剂达到最大活性
⑤升温:促进溶液中的气体逸出,使某物质达到沸点挥发
⑥加热煮沸:促进水解,聚沉后利于过滤分离
⑦降温:防止物质高温分解或挥发;降温(或减压)可以减少能源成本,降低对设备的要求;降低晶体的溶解度,减少溶解损耗
(2)为什么温度不可过高
①挥发:防止产品或反应物挥发,降低产率
②氧化:防止产品或反应物与氧气反应,被氧化,降低产率
③分解:防止产品受热分解,降低产率
④水解:防止金属离子水解生成沉淀,降低产率
(3)为什么温度为40℃(具体温度)
①温度不可过低:反应速率慢、或转换率低
温度不可过高:防止产品挥发、氧化、分解、水解
(4)方法:
①水浴、冰水浴、油浴、沙浴
②缓慢加入××溶液/通入××气体(若为液溴,采用空气吹出法)
2、压强
(1)减压——降低物质熔沸点、提高转换率
(2)加压——提高反应速率、提高转化率
3、控体系的环境氛围
(1)制备无水晶体:干燥的酸性气流氛围下,抑制水解并带走因分解产生的水汽
(2)还原性氛围:防止××(还原性物质)被氧化
(3)加氧化剂氧化
(4)通入无关气体的目的:
①排净装置内空气,防氧化
②使产生的物质完全被××溶液吸收,提高产率,防止污染空气
③排净装置内空气,放爆炸
④防倒吸
(5)通入(加入)过量某种反应物的目的
①是反应更充分,提高产率
②保持浓度,保证反应的发生
(6)加入与反应无关的液体(固体)的目的
①冰晶石:助溶剂
②防止(降低)××挥发
③催化剂
3、加过量试剂:使反应完全进行(或增大转化率、产率)等
4、加氧化剂:氧化某物质,生成目标产物或除去某些离子或转化为易于被除去(沉淀)的离子
5、加还原剂:还原某物质,转化为易于被除去(沉淀)的离子
五、除杂
1、水解沉淀
(1)调节pH使杂质离子完全水解沉淀。
(2)一般需要将Fe2+氧化成Fe3+,否则铁元素无法除尽或使产品元素损失。
(3)沉淀时pH范围的原因:范围过小导致某杂质离子沉淀不完全,范围过大导致产品离子开始沉淀,造成产率降低。
2、置换沉淀
用目标产品元素单质,置换出难以水解出去的杂质离子,且活动性小于产品元素。
3、特殊沉淀
F-——除去Ca离子
S2-——除去Cu、Fe、Pb、Hg离子
SO42-——除去Ba、Pb离子
六、用理论或原理方面回答问题
1、解释速率变化的原因,回答问题的角度:从T、P、c、催化剂、形成原电池以及固体颗粒表面等条件对反应速率的影响角度
2、提高产率方法:从T、P、c对平衡移动的影响角度,从条件改变使平衡向正反应方向移动来进行叙述
3、物质循环利用目的:提高原料利用率;降低成本;绿色化学
4、物质循环利用的判断:催化剂等辅助原料,母液可循环利用;产品和杂质肯定不循环

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1.增大原料浸出率(离子在溶液中的含量多少)的措施:搅拌、适当升高温度、延长浸出时...
一、目的(分离提纯、生产制备) 1.使某些金属离子形成氢氧化物沉淀,或防止某些金属离...
硫代硫酸钠的工业制法: (1)亚硫酸钠 将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用...
第一种——酸浸 1 、定义: 是指是用无机酸的水溶液作浸出剂的矿物浸出工艺。它是化学...
第一种——灼烧 1、定义: 煅烧将固体物质加热到高温以达到脱水、分解或除去挥发性杂...
一、预处理 1、研磨、粉碎、喷洒、雾化:将块状或颗粒状的物质磨成粉末或将液体雾化,...