
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
键解离能、键能、反应焓变是常见的化学用语。通过调查四川省参加“国培计划”的教师发现,大多数教师对上述3个概念极易产生混淆。主要表现之一是多数教师认为键解离能与键能完全等同,即键解离能与键能是同一概念。此外,对于键能和反应焓变的关系,多数教师认为:化学反应焓变可以通过反应物的键能之和减去生成物的键能之和来进行计算。该观念产生的重要案例是H2(g) + 1/2 O2(g) = H2O(g)和1/2 H2(g) + 1/2 Cl2(g) = HCl(g)反应生成焓的计算。表1是H2O(g)和HCl(g)的生成焓和相关键能数据。
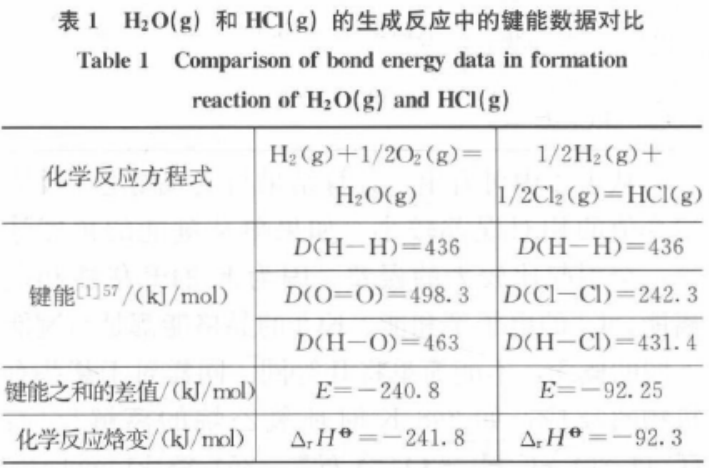
按照上述反应焓变与键能的关系,可以计算出“键能之和的差值”E与文献中“反应焓变”ΔrHF的值极为相近,说明这一观念的正确性。
但是,化学作为一门严谨的学科,仅从H2O(g)或HCl (g)的生成反应实例作为反应焓变计算的定论未必可信,只要考查反应H2(g)+ 1/2 O2(g) = H2O(g)就能发现,液态水的生成反应的反应焓变为-285.8 kJ/mol,与表1中键能之和的差值相比有较大误差,可知上述由键能计算反应焓变的方法是不准确的。据此,研究键解离能、键能、反应焓变的概念和它们之间的关系是很有价值的,以期让教师在教学中能准确应用。
1、键解离能和键能
键解离能定义为[2]964:在绝对零度时,将处于基态的R-X拆开成处于基态的R和X时,所需要的能量称为R-X的键解离能。键解离能常用符号为D0(R-X)。R-X的解离可用下式代表:R-X → R + X。 D0(R-X)= ΔfH0(R)+ ΔfH0(X)-ΔfH0(RX)。人们通常习惯使用298.15 K时的键解离能值。例如NH3中N-H键的解离能如表2所示。
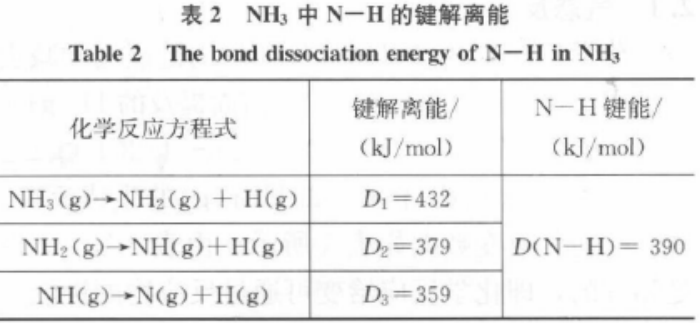
由此可见,同一种化学键的解离能可以为不同值,所以难以在热化学中作为一个定量加以使用。
《物理化学》教科书中提出[1]55,“键能是指断裂气态化合物中某一具体化学键生成气态原子或原子团时所需的能量”。《无机化学》中提出[3],“键能为在常温下基态化学键分解成气态基态原子所需要的能量”。Lou[2]964认为,键能包括断裂多种物质中化学键时所需的能量,不仅仅是指气态化合物。因此,此观点的应用必须考虑具体的反应环境,即反应物与生成物的状态、物质间的相互作用等。
键能是键解离能的平均值,如表2所示,N-H键能即为3个解离能之和的平均值。对于双原子分子,键能等于键解离能。对于多原子分子,键能与键解离能有所区别。例如298K时,1 mol NH3(g)中的N-H键能为390kJ/mol,此处的键能即是上述N-H的键解离能的平均值。键解离能应考虑具体的解离物和解离环境,同种键的键解离能可以有多个值,而键能则把不同解离环境中的某种键视为同一键,具有相同的数值。所以,键解离能与键能是“个性”与“共性”的关系,键解离能精确可靠,而键能使用更方便快捷。需要注意的是中学阶段键能计算运用的是平均键能法,而平均键能只是键能计算的方法之一,随着科学的进步,实际运用中为了使用快捷,键能往往直接从各种热化学数据库和化学键能数据库中得出,如CRC化学与物理手册[2]965、NIST热力学数据库(http://webbook.nist.gov/chemistry/)、化学键能数据手册[4]等。
2、反应焓变和键能
一切反应都可以视为反应物各种化学键的断裂和生成物各种化学键的形成。伴随着化学键的断裂和生成,反应吸收或放出热量。反应焓变也是反映化学反应能量变化的热化学量,反应焓变可以由反应物与生成物各种化学键的键能的差值来计算吗?针对此问题,可分为2种情况加以分析:
2.1气态反应
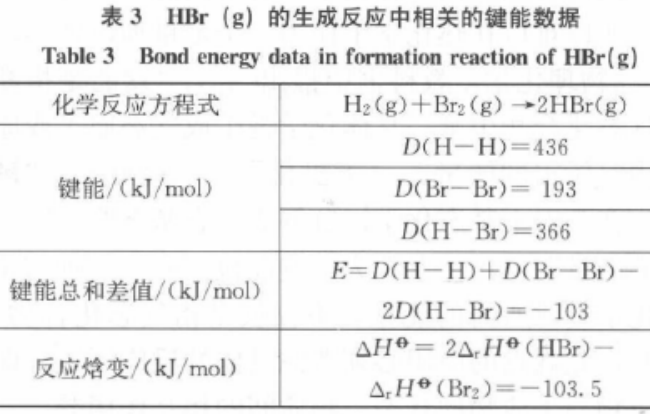
化学反应焓变可以通过反应物的键能之和减去生成物键能之和来进行计算。如前面提及的H2(g) + 1/2 O2(g) = H2O(g)和1/2 H2(g) + 1/2 Cl2(g) = HCl(g)的反应焓的计算。如HBr(g)的生成反应,相关键能和焓变数据如表3所示。由表3知,2者是相等的,即化学反应焓变可通过反应物的键能之和与生成物键能之和的差值来计算。
2.2有凝聚态参加的反应
此种情况下,化学反应焓变不能通过反应物的键能之和减去生成物键能之和来进行计算。但可以通过其他方法计算。
如KCl(s)的生成反应:2K(s) + Cl2(g) →2KCl(s),根据盖斯定律,可将凝聚态的K(s)和KCl(s)转化为气态微粒后进行计算,如图1和表4所示,上述反应的焓变ΔrHF可由以下反应计算得出:

表4 由盖斯定律计算KCl(s)生成反应的化学反应焓变
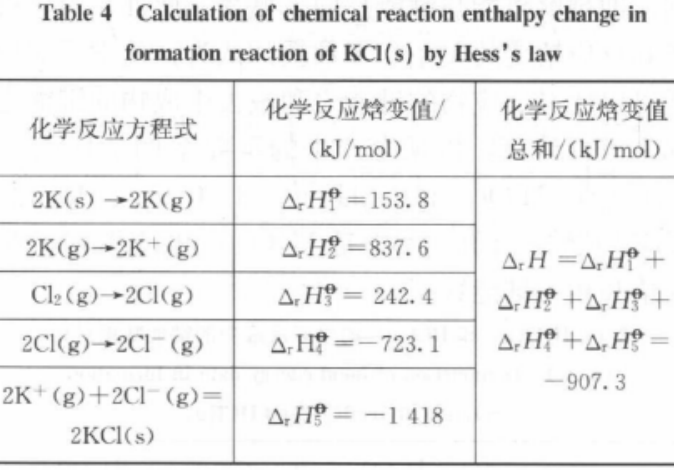
从表4中可看出,计算结果与实验测定的反应焓变值的相对误差较小,如果单从键能的角度计算,会引起比较大的误差。因为K的升华能和电离能、Cl的电子亲和能、KCl的晶格能都是与键能不同的概念,不能简单将其等同。同样对于某些有机物的反应,如298 K时环氧乙烷的离解反应:(C2H4)O→ C2H4 + O,ΔrH= 354.38 kJ/mol [5],该反应断裂了2个C-O,σ键,形成了C-C和π键。如果按照键能来计算则ΔrH=D(C-C) + 2D(C-O) - D(C=C) = 434kJ/mol,相对误差已达到了18%。
中学阶段的键能一般用来描述相邻2个原子间的键断裂所需要的能量。对于环状物等复杂有机物,不能运用相邻2原子的键能来解释反应焓变。总之,从键能来计算反应焓变,不能简单地从反应物键能之和减去生成物键能之和来进行计算,要考虑具体的反应环境。
3 结语
键解离能、键能、反应焓变3个概念容易混淆。键解离能考虑了具体的解离环境,反映了化学键具有的个性或特殊性。键能反映同类化学键的共性。反应焓变并不简单地取决于反应物和生成物的键能总和之差,从键能角度计算反应焓变还需要考虑具体反应物和生成物的反应环境等影响因素。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1 、关于化学反应能量变化的说明: ( 1 )高中阶段的化学反应局限在原子、离子、分子...
化学反应的嬉变是新课标要求掌握的一个基本 概念,它与键能的关系密切。这是因为反应...
键解离能、键能、反应焓变是常见的化学用语。通过调查四川省参加“国培计划”的教师发...
有机反应沿着不同的反应历程会得到不同的产物,如果反应还未达成平衡前就分离产物,利...
中学化学教材(人教版)选修四《化学反应原理》第 二章第四节的内容是“化学反应进行的...
热力学是研究能量相互转变过程中所遵循的法则的一门学科,属于物理学的分支,化学热力...