
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
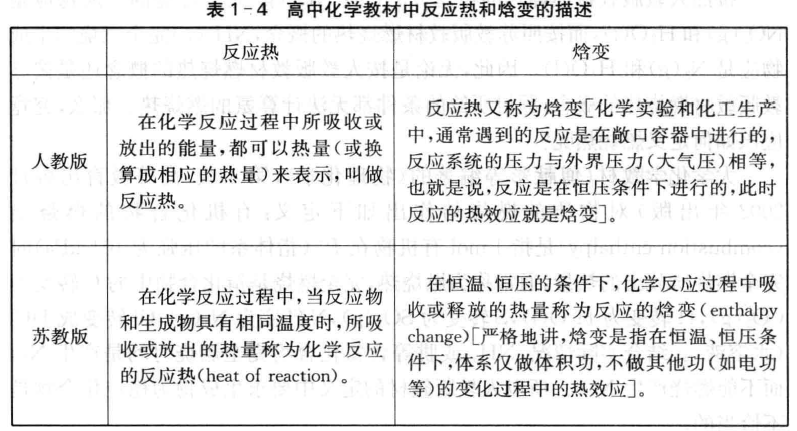
为什么不同教材中对焓变的描述不同呢,焓变与反应热之间的关系如何?
在热力学中,用Q表示反应过程中的热量变化。若反应吸热,则Q<0; 若反应放热,则Q>0。当体系处于变化过程时(反应物转变为生成物也是体系 的变化),体系与环境之间存在图1 - 8所示的能量交换。
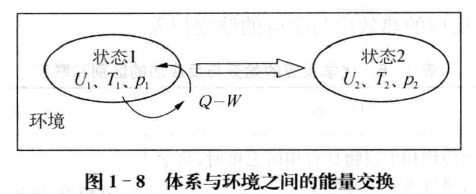
当体系变化恢复到原来温度时,体系内能的变化为
ΔU =U2-U1= Q-W (1)
若体系只做体积功,不做其他功(如电功等),
ΔU = U2-U1 =Q-W体积 (2)
如果是恒容变化过程,ΔV = 0,则W体积=0
ΔU = Qv (3)
(1) 式中Qv为恒容热效应,此时体系吸收的热量全部用来增加内能。如 果是等压变化过程,则p1= p2 = p,Q = Qp,为恒压热效应。
ΔU = U2-U1 = Qp-p(V2-V1) (4)
(4) 式也可写成
Qp = (U2 +pV2)- (U1+ pV1) (5)
定义H为体系的焓,H = U + pV,则体系的焓变ΔH为
ΔH = H2 - H1=(U2 + pV2) — (U1+pV1) = Qp (6)
对于化学反应而言,化学反应的焓变是生成物的焓与反应物的焓的差,由于和内能一样,物质的焓的绝对值是无法测量的,因此,化学上规定:在标准状 态(298 K、101 kPa)下,稳定单质的标准生成焓为零,其他物质的生成焓就可通过测定反应的恒压反应热推算得到。通过物质的标准生成焓可以推算化学反应的焓变:
![]() (7)
(7)
式中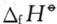 是物质的标准生成焓。从上面的推导可以发现,在恒温、恒压、体系 不做非体积功的条件下,体系从环境吸收的热量全部用于增加体系的焓,也就 是说,在恒温、恒压、体系不做非体积功的条件下,化学反应的热效应与反应的焓变相等。
是物质的标准生成焓。从上面的推导可以发现,在恒温、恒压、体系 不做非体积功的条件下,体系从环境吸收的热量全部用于增加体系的焓,也就 是说,在恒温、恒压、体系不做非体积功的条件下,化学反应的热效应与反应的焓变相等。
在中学化学课程中,若不注明条件,反应均指在恒温、恒压下进行。中学化学课程中的热化学方程式都没有注明条件,所以均是指等压条件下反应的热效应。此时,反应的热效应与反应的焓变相等。

在中学化学教学中,不少教师将反应的恒压热效应与焓变建立关系时,对 一定要不做非体积功的要求不甚理解,我们通过可以下面的例子来认识这一 问题。有如下反应:
Cu(s) + 2Ag+ (aq)==Cu2+(aq) + 2Ag(s) ΔH =— 147. 39 KJ• mol-1
将该反应安排在如图1 - 9所示的两种情况(都是恒温、恒压)下进行:
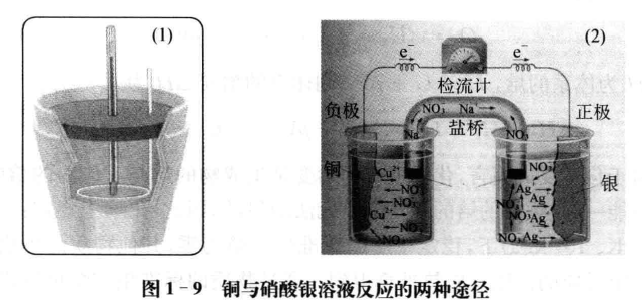
铜与硝酸银溶液的反应在装置(1)中进行时,不做非体积功,因此测定的反应的热效应就是反应的焓变;而在装置(2)中进行时,由于反应过程中做电功,虽然反应过程中也有热量的放出,但该过程中反应的热效应绝不等于反应的焓变。
在中学化学教学中,化学课程标准对焓变的要求是这样的:了解反应热和 焓变的含义,能用盖斯定律进行有关反应热的简单计算;能用焓变和熵变说明 化学反应的方向。说明在中学化学教学中,还仅是要求学生从反应热的角度 去认识反应的焓变,因为学生对化学反应的吸热和放热既有知识基础也有生活经验,理解比较容易。因此,我们不必要求学生掌握焓变的严格概念,也不 必要求学生对非体积功作更多的了解,只要让学生知道,大多数化学反应都是 在恒温、恒压下进行的,恒温、恒压下化学反应热就是反应的焓变。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1 、关于化学反应能量变化的说明: ( 1 )高中阶段的化学反应局限在原子、离子、分子...
化学反应的嬉变是新课标要求掌握的一个基本 概念,它与键能的关系密切。这是因为反应...
键解离能、键能、反应焓变是常见的化学用语。通过调查四川省参加“国培计划”的教师发...
有机反应沿着不同的反应历程会得到不同的产物,如果反应还未达成平衡前就分离产物,利...
中学化学教材(人教版)选修四《化学反应原理》第 二章第四节的内容是“化学反应进行的...
热力学是研究能量相互转变过程中所遵循的法则的一门学科,属于物理学的分支,化学热力...