
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
所谓绝热就是指反应体系与外界没有热量交换,由于化学反应伴随着热能的释放或吸收,在绝热条件下,反应释放或吸收的热能没有与外界交换,就会导致反应体系的温度产生变化,致使平衡常数发生变化,平衡发生移动。这一类题一般不知道反应热效应,常会出现多种因素同时变化,分析的思路和常规平衡题有所不同,实际教学中发现错误率很高。
那么,怎样准确地分析、解答这一类题呢?下面,我们从几个例题一一入手分析:
例1:(天津卷)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
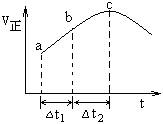
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a-b段小于b-c段
解析:由于是在绝热恒容环境中,起始时充入的仅为两种反应物,且a-b-c的过程中,正反应速率在不断增大,并没有出现正反应速率减小直至不变的预期,所以可以判断,c点之前,控制速率的主要因素不是浓度,而是温度,且该反应为放热反应,这样才会导致c点之前随着体系温度不断升高,反应速率不断增加;c点之后控制速率的主要因素变为浓度,由于此时反应物浓度下降带来的影响超过温度的影响,所以正反应速率开始下降;这里要注意的是,由于是绝热体系,温度因素始终存在,只是相对于浓度因素而言,其在c点之后居于次要地位。综上所述,c点并未到平衡,且反应物的总能量高于生成物的总能量;A、C错。
B选项最难判断,由于整个过程始终没有达到平衡,并且题目没有在同一坐标系中给出V(逆的图像),所以不能直观地判断出a-b过程中平衡移动的方向;但是,我们不妨假设a-b过程中平衡逆向移动,则必定导致反应体系温度降低(逆向吸热),那么根据之前的分析,C点之前由于整个体系的反应速率主要由温度控制,那么,体系温度若降低必将导致a-b段正反应速率下降,而不会上升;所以,a-b段平衡是朝正向移动,a点反应物浓度大于b点反应物浓度,B错。
最后,SO2为反应物,所以单位时间内,正反应速率越大则其转化率越高,D正确。
反思:
这道题的关键点有三个:
1,判断正反应热效应;
2,判断各段控制速率的主要因素;
3,用假设法判断图中某一段的平衡移动方向。
例2:(江苏卷)一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L 恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2和1mol H2,在III中充入2mol CO和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L 恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2和1mol H2,在III中充入2mol CO和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的多
D.容器I中CO的转化率与容器II中CO2的转化率之和小于1
解析:容器I中的平衡是从反应物朝生成物的方向建立的,容器II中的平衡是从生成物方向开始的,由于正反应放热,达到平衡时,体系I温度>700℃>体系II温度,此时,无论是比较正反应速率还是逆反应速率,都是I>II,所以A错。
III中体系平衡也是从反应物朝生成物的方向建立的,但是由于III中反应物起始浓度是I的两倍,又是恒容体系,所以达到平衡时,体系III温度>体系I温度,则b错。
假设I、II可以建立等效平衡,则I中CO的浓度会逐渐下降,II中CO浓度会逐渐上升,直至二者相等(设为C0),但由于绝热,I、II两体系不可能建立等效平衡,所以I中CO浓度下降不到C0,II中CO浓度也上升不到C0,所以I中CO浓度>II中CO浓度,也即I中CO物质的量>II中CO物质的量,C正确。
D选项也要用假设法来考虑,先假定不是绝热过程,则I、II体系建立等效平衡时I中CO的转化率与容器II中CO2的转化率之和等于1;可假定以此为基础再改成绝热,I中由于正反应放热,导致温度升高,进而使平衡朝生成CO的方向移动,使CO的转化率下降;同理II中因逆向反应吸热导致温度降低会使CO2的转化率下降;进而二者的转化率之和小于1,D正确。
反思:
这道题的关键点有两个:
1,判断各体系平衡时温度大小关系,进而得出A、B错误;
2,用假设法,推想I、II两体系建立等效平衡时的情况,再与绝热条件下的实际情况进行对比,就可得出C、D正确。
例3:(重庆卷)在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g) 2C(g) ΔH1<0;
2C(g) ΔH1<0;
X(g)+3Y(g) 2Z (g) ΔH2>0
2Z (g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,C的物质的量不变
B.等压时,通入Z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入Z气体,Y的物质的量浓度增大
解析:等压时,充入惰性气体后第二个反应朝逆反应方向进行,放热,导致整个体系温度升高;而第一个反应正向放热,温度升高会导致其朝逆向移动,C的物质的量减少,A错。
等压时,通入Z,第二个反应逆向进行,且体系温度升高,B、D正确。
等容时,通入惰性气体,各气态物质分压不变,各反应速率不变,C正确。
反思:
这是一道两个反应同时进行的混合体系,要考虑到两个反应间在不同情况下是否存在协同或矛盾效应,关键点在于准确判断不同条件下体系温度的变化对两个反应的影响。
例4:(福建卷)在恒容绝热(不与外界交换能量)条件下进行:2A(g)+B(g) 2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:
2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:
物 质 | A | B | C | D |
起始投/mol | 2 | 1 | 2 | 0 |
解析:因为一开始没有投入D物质,所以反应应该向正向进行,则气体的物质的量会减少,似乎压强会变小,但实际压强却增大了,因此,该反应只能是放热反应,所以平衡常数会随着温度的升高而减小。
反思:该题关键在于发现隐藏线索——达到平衡时,体系压强升高,由此可判断反应热效应,最后根据温度对平衡的影响就可以作答。
反思:该题关键在于发现隐藏线索——达到平衡时,体系压强升高,由此可判断反应热效应,最后根据温度对平衡的影响就可以作答。
例5:(武汉二月调考)苯乙烯是化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2催化脱氢制得。总反应原理如下:
![]() ΔH=+158.8 kJ·mol-1
ΔH=+158.8 kJ·mol-1
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L 的密闭容器中加入乙苯与CO2,反应到某时刻测得该混合物各组分的物质的量均为1.0mol。
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度______(填正确答案编号)。
A.大于0.5 mol/L B.小于0.5 mol/L C.等于0.5 mol/L D.不正确
解析:该题第二问中的第三小问与绝热过程有关。由于该反应的反应物一边和生成物一边气态物质系数和不相等,当初始投料为乙苯和CO2时:因为反应向正向进行,气体的物质的量n(要变大);但是,该反应又是吸热反应,温度又会下降,因此根据理想气体状态方程PV=NRT,,n(变大)、T变小、P不变,因此V(无法确定),所以乙苯的物质的量浓度也无法确定,选D。
反思:这一题中反应朝正向进行,带来两个因素的变化,其体积变化无法确定,所以才导致平衡时物质的量浓度无法确定。
总结解决绝热体系中的化学平衡问题有如下几个要点:
1. 首先要准确判断初始时反应方向,进而判断出初始时体系温度变化。
2. 然后判断温度改变和其它条件改变对平衡的最终影响,如果最终影响无法判断,则往往无法确定其它量的变化。
3.绝热条件下三种等效平衡的判断规律都无法使用,但是可以用假设法,如讨论转化率时可以先假设是恒温恒压或恒温恒容能建立等效平衡,再改成绝热情况,看对原等效平衡有何影响,从而得到正确答案。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是活化能、能垒? 1 、能垒 活化分子含有的能参加化学反应的最低限度的能量,称为...
化学学习过程中,我们经常碰到这样一类问题,如图一,由始态经途径I直接到终态,理解...
第一页 第二页 第三页...
1. 速率—时间图像的“断点” 当可逆反应达到一种平衡后,若某一时刻外界条件发生改...
...
一元弱酸,指理想状态下一分子一元弱酸可以电离出一分子氢离子,由于是弱电解质,则无...