
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

这一概念在课本上讲的并不是非常的透彻,会对深度学习造成理解上的障碍。因此我们要系统性的学习这部分概念。
基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应。化学反应式多数情况下不能说明反应的过程。现实中有的反应是一步完成,而多数的反应需要经历若干个步骤才能完成。基元反应的动力学规律符合质量作用定律,即:基元反应的化学反应速率与反应物的浓度数值相应方次乘积成正比;其方次即为各物质前面系数,均取正值。
从微观上看,反应物分子一般总是经过若干的简单反应步骤,才最后转化为产物分子的。每一个简单的反应步骤,就是一个基元反应。基元反应步骤要求反应物一步变成生成物,没有任何中间产物。按照基元反应定义,所有的可逆反应均为非基元反应。
基元反应的动力学规律符合质量作用定律,即:基元反应的化学反应速率与反应物的浓度数值相应方次乘积成正比;其方次即为各物质前面系数,均取正值
(1)对于单分子反应:A→产物,对应的反应速率方程式为:v=k{c(A)}
(2)对于双分子反应A+B→产物或2A→产物,对应的反应速率方程式分别为:v=k{c(A)}{c(B)}或者v=k{c(A)}2
(3)对于三分子反应
A+B+C→产物
或者2A+B→产物
或者A+2B→产物
对应的反应速率方程式分别为:
v=k{c(A)}{c(B)}{c(C)}、v=k{c(A)}2{c(B)}或者v=k{c(A)}{c(B)}2
上述k值为速率常数,与温度和催化剂有关,和反应物浓度无关。
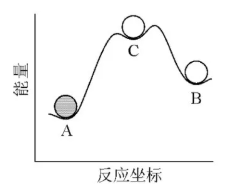
在《物质的稳定性示意图》,A与C之间的变化是一个基元过程,C与B之间的变化也是一个基元过程, 但A与B之间的变化不是一个基元过程,因为其中有两个能峰。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是能垒、活化能?二者有什么区别? 1、能垒 活化分子含有的能参加化学反应的最低...
1.无论是用某一反应物表示还是用某一生成物表示,由于Δ C 是取浓度变化的绝对值,因...
在一个恒温恒容的密闭容器里,充入2mol SO 2 和1mol O 2 ,发生如下反应并建立化学平...
...
一、人物简介: 阿伦尼乌斯·斯万特·奥古斯特(1859年2月19日~1927年10月2日)瑞典物...
本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。 本题...