
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
含有一个双键的开链状的脂肪烃化合物称为烯烃。
第一节:烯烃的同系列
烯烃是具有一个碳碳双键〉C=C (结构的烃,它比同级的烷烃少两个氢原子。烯烃同系列通式CnH2n(n>2)。烷和烯,同 样是“火”偏旁,可是前者的右半边是“完”,这意味着化合物中 可能有的氢,完全都有了;而烯字的右半边是“希”,意味着氢比 较稀少。
含有两个双键的烯烃,如丁二烯、异戊二烯都是二烯烃化 合物。
烯烃属于不饱烃的一种,在化学工业中具有重要的地位。
第二节:乙烯及其同系物
按照烯烃通式CnH2n(n>2),最低级的烯烃是乙烯C2H4,比它更低 的“甲烯”(CH2)是不能分离得到的。烯烃表示分子中的氢比烷烃稀少,每一个分子比相应的烷烃少两个H,按此定义,C3H6叫 做丙烯,C4H8叫做丁烯……。它们都是属于乙烯的同系物。它们 之间的系差都是一CH2—。
第三节:烯烃的结构
烯烃之所以是不饱和烃,因为在它分子中两个碳原子之间有一个双键,又称不饱和碳碳双键。在一定条件下,双键和一个氢原子结合,烯烃就又变成烷烃了。
烯烃的双键意味着两个碳原子各自用价电子彼此结合,每个 碳只剩下另外两个价电子与氢或烃基结合。
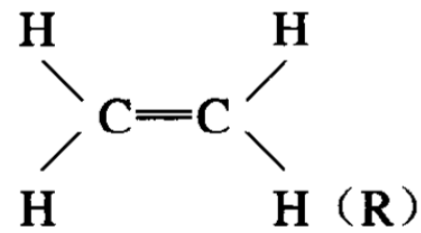
形成双键的两个碳原子,在杂化理论看来,也是进行了轨道杂化的。这两个碳原子的最外层电子,都由2s2p2跃迁为2s1p3
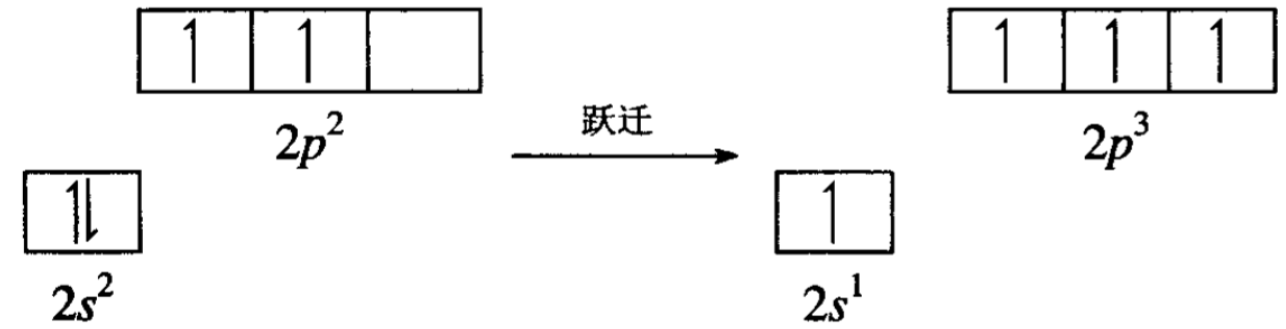
然后再由一个s轨道和两个p轨道进行杂化,组成三个完全等同的杂化轨道,而第三个p轨道仍保持原来的形状,这就是所谓的sp2杂化。
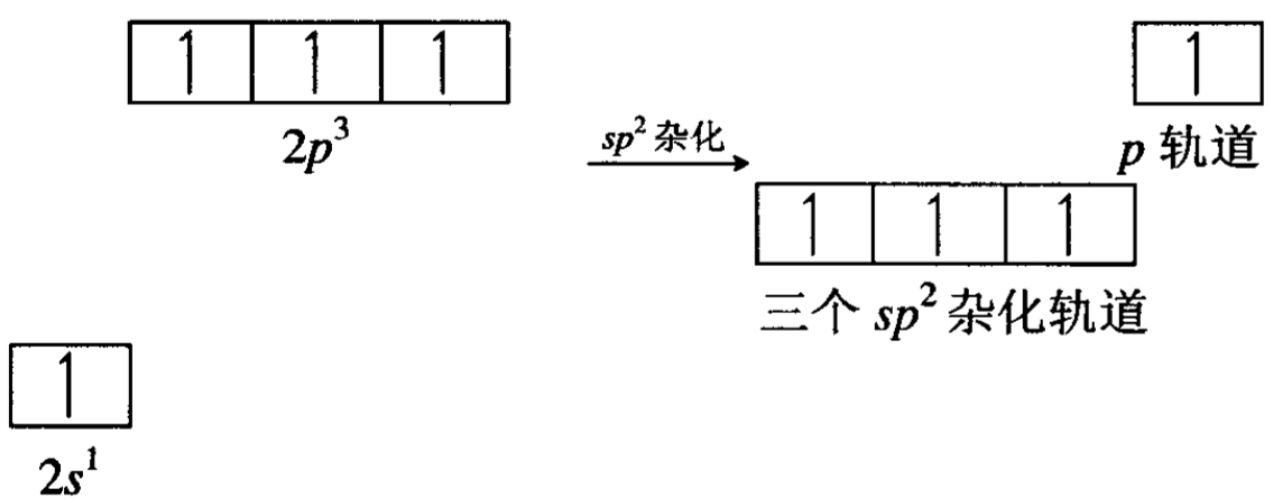
杂化轨道部分在同一平面上,两个进行sp2杂化后的碳原子,分别提供一个杂化轨道形成σ键,其余的四个轨道分别和四个氢原子形成σ键。每个碳原子上还剩下一个p轨道,这两个2p轨道垂 直于纸面,对称轴互相平行,它们可以在侧面进行交盖:
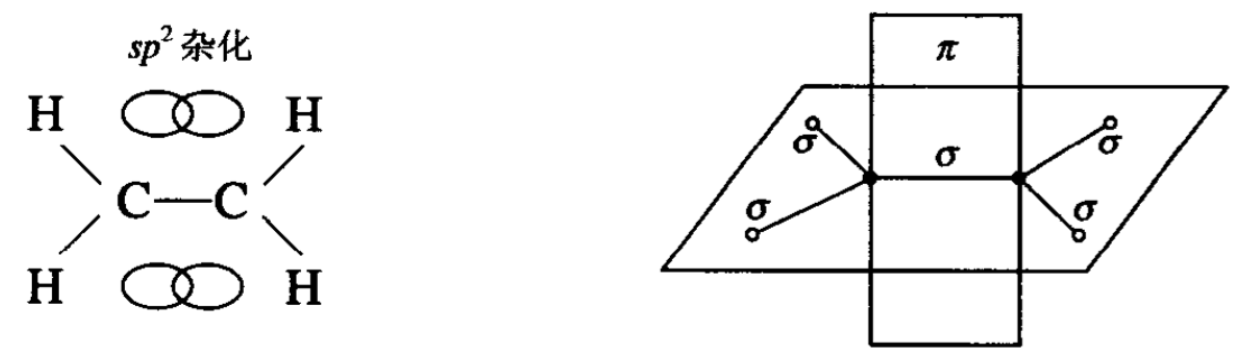
可以看出,两个碳和四个氢都是在一个平面上的,键角(指两个相邻的σ键所形成的夹角)为120°,两个垂直于平面的2p轨道仍然保持原来“哑铃”形,分布在平面上下,它们互相交盖形成了 一种π键。双键的电子对有两对,一对沿着σ键把C一C连接起 来,另一对在π键中运动着。总的来说双键由于两对电子对参与成键,所以键能比单键大(即把两个以双键结合的碳原子分开的能 量),但不是单键键能的2倍。双键键能为610.4kJ/mol,单键键能 为345.8kJ/mol,双键键能只有单键键能的1.75倍左右,说明π键本身的键能比σ键小。
显然,由于π键的两个p轨道是平行交盖的,所以如果形成π键的两个原子作相对运动,而使两个p轨道不处于平行位置时, 必然会减少两个轨道的交盖程度,从而降低了π键的强度。所以 一般说,π键是不能“自由”旋转的。
第四节:烯烃的同分异构
烯烃和烷烃一样有碳键异构现象,从四个碳的烯烃开始有正 丁烯和异丁烯,前者是直链的,后者是支链的烃。但是由于双键在烃分子位置的不同,烯烃又产生了另一种同分异构现象。以正 丁烯为例,双键可以在碳键的1-2位碳原子之间,也可以在2-3位 碳原子之间,这样就造成了丁烯有两种异构体,即1-丁烯和2-丁烯。
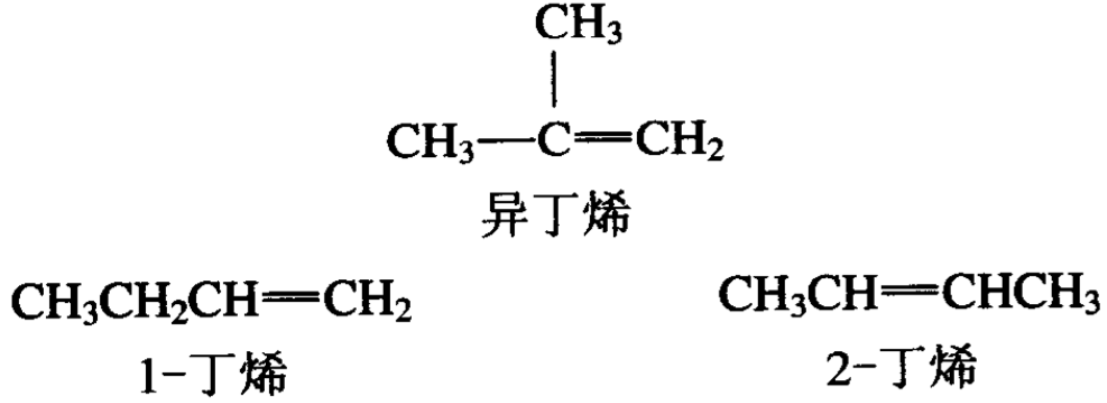
1-丁烯和2-丁烯都可以由正丁烷导出,它们的碳骨架相同, 而双键的位置却不相同,这种异构现象又叫做位置异构,以区别 碳链形式不同的碳链异构。这三种丁烯都有同一分子式C4H8,所 以彼此总的来说也是同分异构的关系。
在一个长的碳链中,任何地方都可以出现一个双键。如果有 支链,双键也可以出现在支链中。一个分子中的双键可以不止一 个。例如,有些重要的有化合物,它们的分子中有十几个甚至更 多的双键。每一种不同的排列,每一个不同的位置,都代表一个 独特的化合物。因此,便会有更多的同分异构,便会有成千上万 种有机分子。
第五节:烯烃的物理性质
在室温下含2〜3个碳原子的烯烃为气体,含5~18个碳原子的 为液体,含19个碳原子以上的为固体。在这些性质上它们和相应的烷烃相近,可见从分子中去掉两个氢原子,分子改变不大,对 于物理性质没有多大影响(见下表)。
名称 | 分子式 | 熔点,°C | 沸点,°C | 密度,g/cm3 |
乙烯 | C2H4 | 一169.15 | -103.71 | 0.5674(-103°C) |
丙烯 | C3H6 | 一185.25 | -47.7 | 0.5139 |
1-丁烯 | C4H8 | 一130.35 | - 6.26 | 0.5951 |
异丁烯 | C4H8 | -140.35 | -6.90 | 0.5942 |
1-戊烯 | C5H10 | -165.22 | 29.97 | 0.6405 |
2-甲基丁烯 | C5H10 | 一137.56 | 31.10 | 0.6557 |
2-甲基-2-丁烯 | C5H10 | -168.50 | 20.06 | 0.6325 |
1-己烯 | C6H12 | -139.0 | 63.55 | 0.6732 |
1-庚烯 | C7H14 | —119.0 | 93.1 | 0.6919 |
1-辛烯 | C8H16 | 一101.7 | 121.3 | 0.716 |
1-十八稀 | C18H36 | 18 | 176 | 0.791 |
第六节:烯烃的化学性质
烯烃氧化产物三
锰盐催化烯变酸
氯盐催化烯变醛
高温银催烯变烷
烯烃加成产物烷
低温能和溴作用
反应产物溴乙烷
醇的生成氯酸化
醋的生成埽和酸
二烯聚合成一烯
硫酸催化温度宜
烯烃水合产物醇
温度压力催化剂
一烯歧化成二烯
钨钼作用不分离
一、烯烃氧化产物三,锰盐催化烯变酸
烯烃像烷烃一样能在空气中燃烧,最后生成CO2和H2O。如 果控制氧化条件,烯烃比烷烃容易发生部分氧化,反应结果常使 双键断裂产生相对分子质量较小的羧酸,所以烯烃能使高锰酸钾 (氧化剂)溶剂褪色。其反应方程式如下:
![]()
二、氯盐催化烯变醛,高温银催烯变烷
烯烃的氧化物也是多种多样的,例如,乙烯在一定的条件下 也可被空气(或氧气)氧化生成乙醛或环氧乙烷。
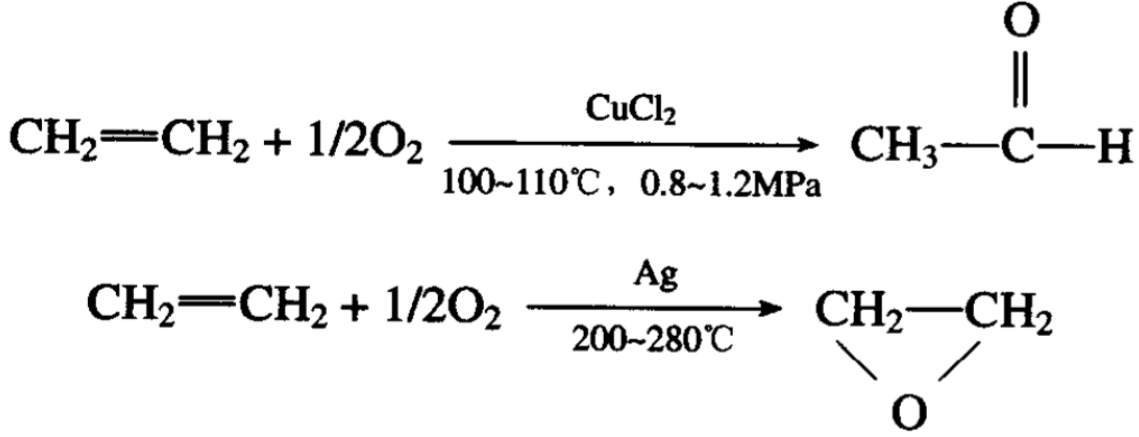
当反应温度过高,会引起已生成的环氧乙烷进一步氧化为二 氧化碳:
![]()
三、烯烃加成产物烷
烯烃在液相或气相下都可与氢加成,但必须有催化剂的帮助,所以这个反应叫做催化氢化。这个反应在工业和研究工作上都很重要。
![]()
催化剂的种类很多,效能最高的是铂,其次是镍,其他如铁、 钴、铜都有催化氢化作用,它们在适当温度压力下使氢加于双键。
四、低温能和溴作用,反应产物溴乙烷
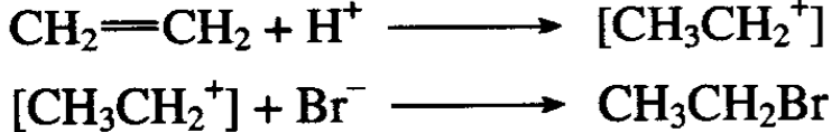
乙烯和溴化氢在低温下,在溶液中加成,成为溴乙烷:
![]()
这个反应说明溴化氢是按氢正离子和溴负离子分别加到不饱 和双键的两个碳原子上去的。加成反应的过程分为两步。第一步: 氢离子加到双键碳原子的一端,形成乙基正离子,第二步:乙基 正离子再加溴负离子得溴乙烷:
丙烯和溴化氢也可以发生加成反应,反应产物可能有两个:
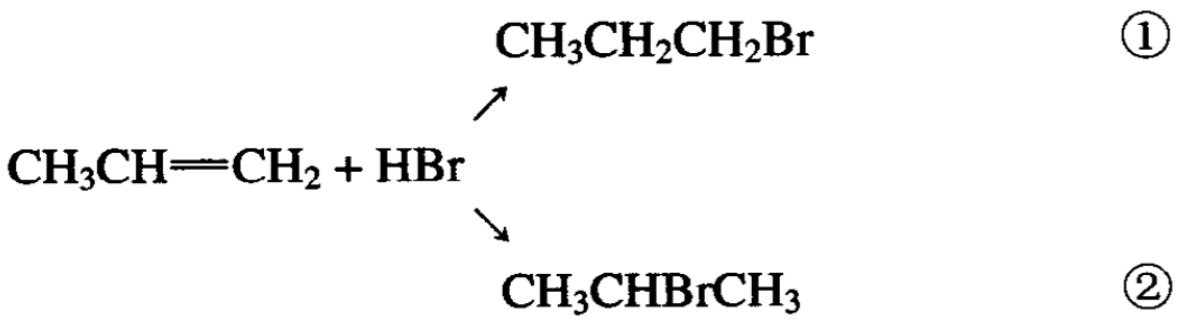
实际上只得到②,即2-溴丙烷而不是1-溴丙烷(反应条件和上述加成方式有很大的关系)。为什么氢倾向于加到末端碳原子上 去?这是不是一种规律?
对于不对称烯烃的加成反应,经过无数实验,证实这种加成方式确实存在着规律,氢总是加在含氢较多的碳上,而齒素或其 他负离子总是加在含氢较少的碳上。这一规律称为马氏加成规律。
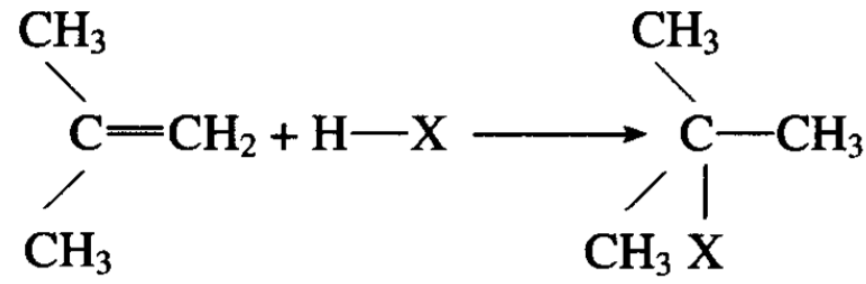
如果从卤化氢分步加成的历程去分析,就可以解释马氏规律。 有机化学反应的历程虽然是一种理论,主要是借助于分子中电子的流动倾向和中间过渡状态的假定,但是它在说明一些反应的现象时,不但得到成功,而且在预测一些反应结果时也取得一些成果。
乙烯、丙烯和卤素的加成分别得到二溴乙烷和1,2-二溴丙烷:
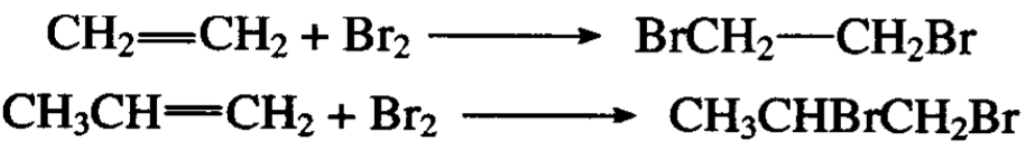
这个反应在工业上用以制取二卤代焼。
五、醇的生成氯酸化
乙烯和丙烯的次氯酸加成或简称次氯酸化具有生产意义,加成的结果分别生成氯乙醇和1-氯-2-丙醇。
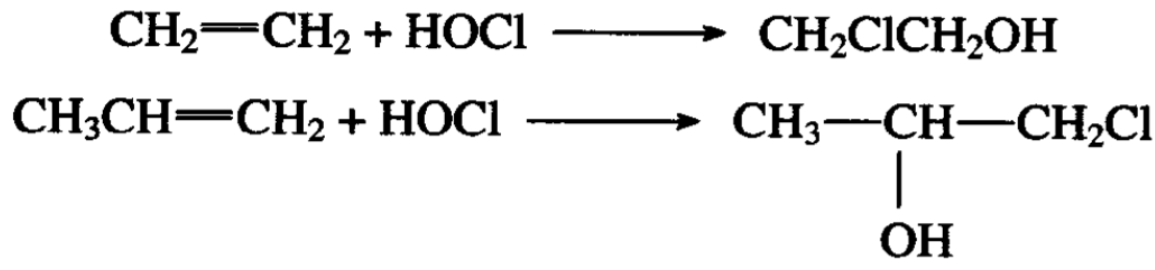
反应是这样进行的,烯烃气体和氯气同时通入含有碳酸钙(或 磷酸钠)的水溶液,把反应液蒸馏分出水后,溶液的高沸点部分 就是次氯酸化产物,其中有少量二氯烷烃可以分馏除去。
电子理论在解释次氯酸化反应中也得到成功。在上述反应液 中,存在着下列平衡:
![]()
在溶液中有少量氯(在氯化溶液中总是有很刺激的氯气味道, 说明平衡体系中有左边反应物的存在),氯分子由于溶液的强烈极化影响,本来中性的氯分子被极化成![]() 的极性分子,后者 接近烯烃分子,对双键发生加成,以氯的正离子形式和双键碳原 子加成:
的极性分子,后者 接近烯烃分子,对双键发生加成,以氯的正离子形式和双键碳原 子加成:
![]()
这是第一步加成,形成的氯乙基正离子要和负离子结合,但 这时溶液中存在着大量OH- (碱性水溶液提供的)更容易和它结 合,就成为次氯酸化的产物。
丙烯的次氯酸化得到1-氯-2-丙醇说明加成是有一定方向的。 和丙烯与卤化氢相比,在这里正电性氯离子代替了氢正离子的地 位,它加在含氢较多的碳上,OH-负离子加在含氢较少的碳上,反 应历程和HX与丙稀加成相同。
次氯酸化的反应产物除乙醇和氯丙醇外,还有二氯烷烃,后 者是氯代烷基正离子与溶液中少量氯负离子加成的产物。
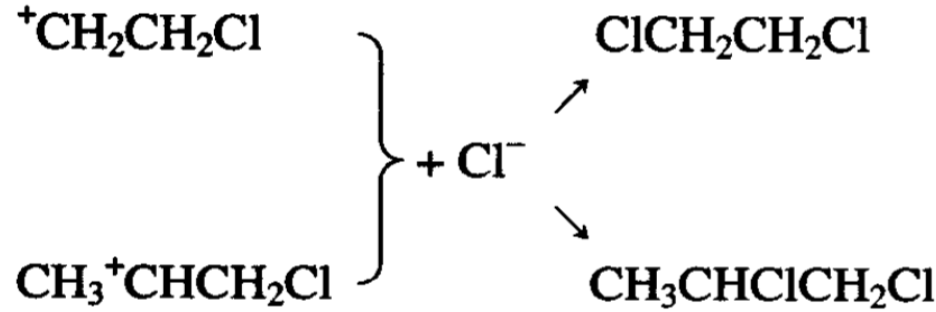
以上反应结果也证明了加成反应是分两步进行的,第一步是 正离子的加成(这一步是决定性的),第二步是负离子和烷基正离 子加成。
六、酯的生成烯和酸
烯烃和浓硫酸发生加成反应,硫酸分子的氢为正离子,硫酸 氢根为负离子,分别加在双键碳原子上。如果烯烃不对称的话, 加成方向遵守马氏规律,例如:
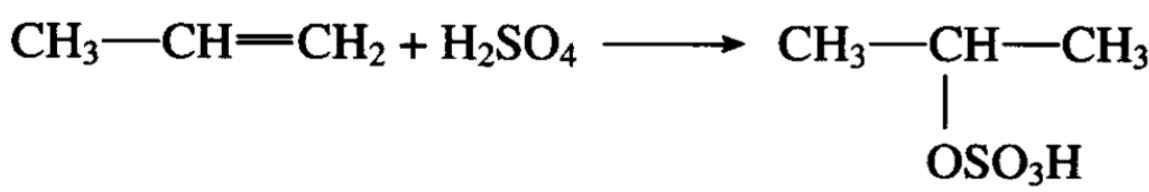
生成的产物是酸性硫酸异丙酯。
乙烯与浓硫酸加成得酸性硫酸乙酯(CH3CH2OSO3H)。
七、二烯聚合成一烯,硫酸催化温度宜
烯烃不仅与其他化合物发生加成反应,还能通过加成的方式 自相结合。这种由同种分子相结合成为大分子的反应称为聚合反 应,参加聚合反应的单分子叫做单体,聚合后所得产物叫做聚合物。
烯烃的聚合,根据反应条件的不同,可以得到不同的产物。 例如浓度50%的硫酸作催化剂,异丁烯能聚合成为双异丁烯(其 主要产物的系统命名法应为2,4, 4-三甲基戊烯)。
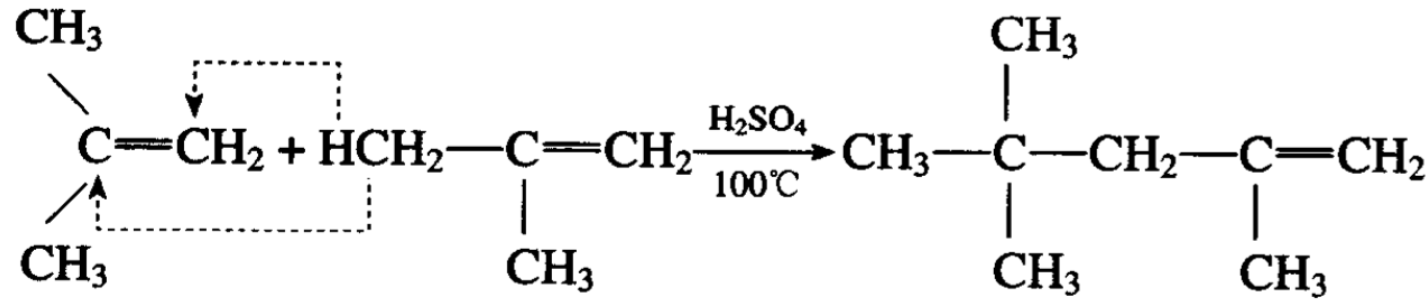
后者进行催化加氢便可得到异辛烷:
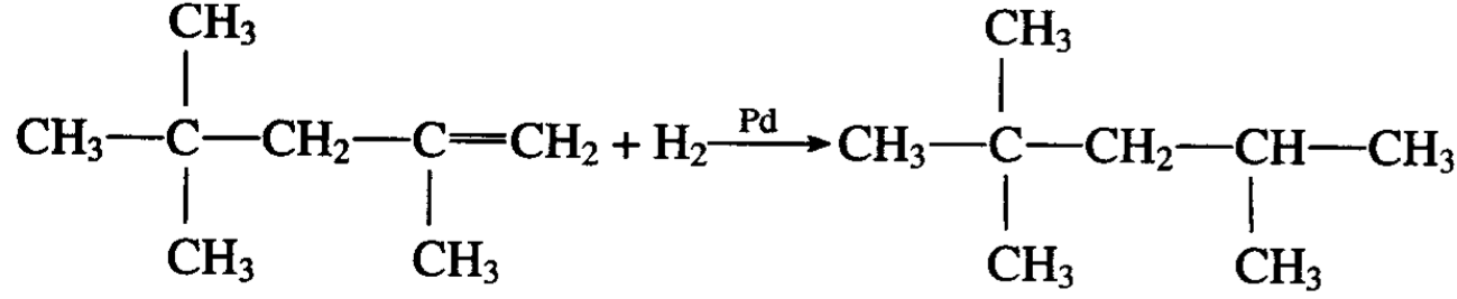
这是利用石油热裂解气中的异丁烯合成高辛烷值汽油组分的一种方法。
如果用三氯化铝或三氯化硼作催化剂,在-100°C的低温下, 异丁烯聚合成为高分子的聚合物,叫做聚异丁烯:
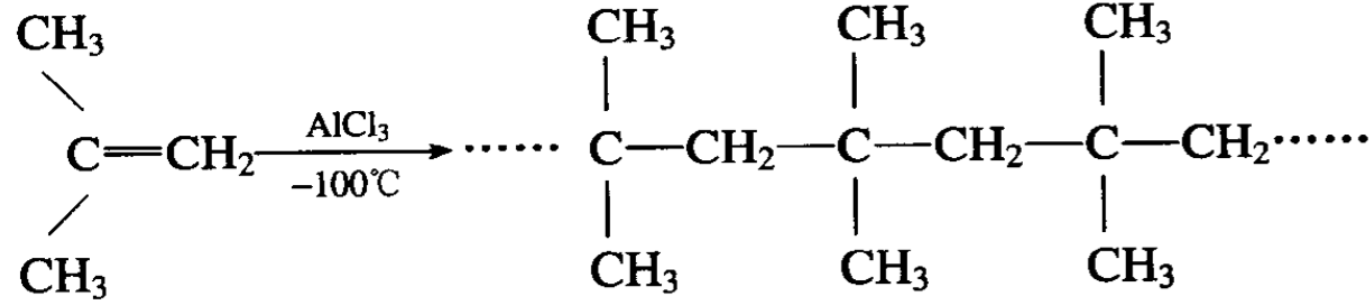
乙烯在适当条件下聚合成高分子,即常见的聚乙烯。
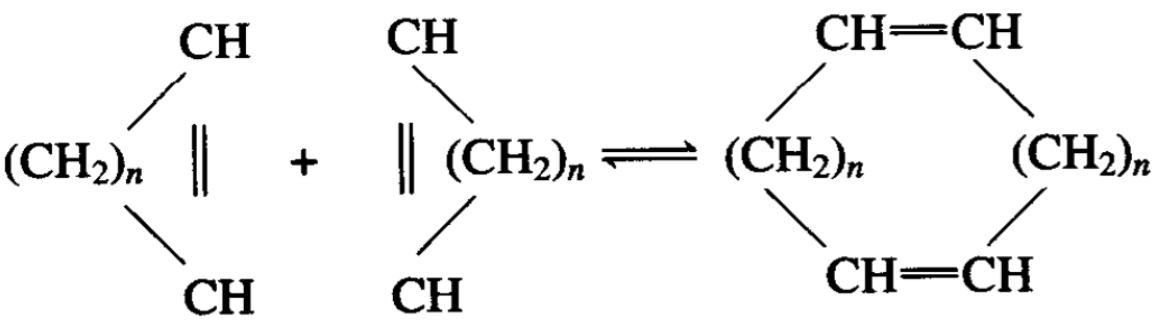
烯烃在镍络合物存在下,可发生二聚反应。烯烃的二聚反应 是一种有选择性地获得新结构烯烃的方法。与镍相连的配位体性 质在某种程度上可以改变烯烃的头对头、尾对尾的键合形式。工 业上应用丙烯和丁烯的共二聚合成庚烯,或是应用丁烯的二聚合 成辛烯。
用基于镍的络合物促进丙烯、丁烯共二聚,可使C6、C7、C8的总选择性超过95%,而对C7的选择性则为50%。所得到产物的 结构与用酸性催化所得的产物结构相比较,侧链大为减少。乙烯 和丁二烯是化工原料主要来源,由乙烯和丁二烯可分步聚合成一 系列化工的中间产物。
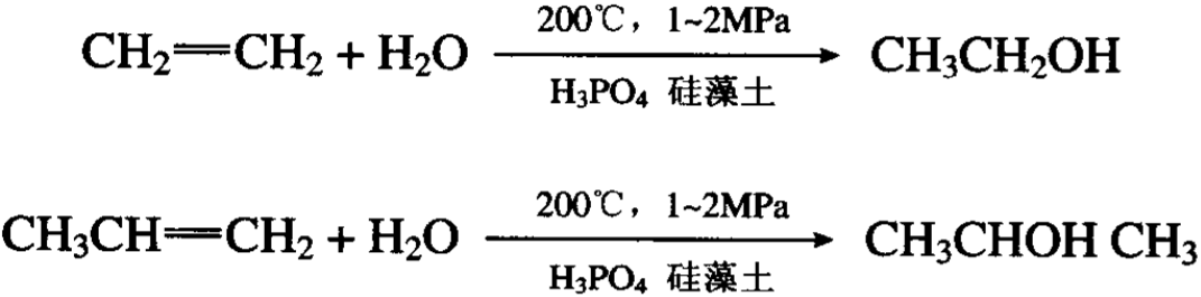
八、烯烃水合产物醇,温度压力催化剂
烯烃不溶于水,在一定条件下不与水作用,在一定的温度和 压力以及催化剂的作用下,烯烃可以和水加成。这一反应对乙烯 和丙烯特别有用,因为它们的直接水合可以生成乙醇和异丙醇, 这是工业上用以制取乙醇和异丙醇的新方法。所用催化剂是磷酸载于桂藻土上:
九、一烯岐化成二烯,钨钼作用不分离
烯烃的歧化反应是一个非常重要的化学反应。近期发现它的 同类的一种反应叫做烯烃复分解反应。在这种反应中,至少包含 三个碳原子的烯烃转变为较短和较长碳链的同系物,例如:
![]()
最终混合物的组成在不同程度上符合于无规则的分布。这个反应是可逆的,并且倘若用一个内烯烃和一个乙烯,则产生两分 子的α-烯烃。这个过程称为乙烯分解。
钨和钼所引起的反应显然可采用现代通用的反应机理予以说明。两个双键与金属配位时使它们的四个碳原子相互分离,于是 这四个碳原子互相结合形成两种新的烯烃。用在氧化铝上负载有 钨或钼氧化物的催化剂,同样能进行这种转化反应。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在高考中考查: 近几年新高考中最早出现非苯环芳香烃相关考查...
立体结构差异 椅式环己烷结构中,碳原子构成的环近似于一个三...
电子效应,在大多数反应中,由于取代基(与氢原子相比)倾向...
一、芳香烃的定义 具有芳香性的烃称为芳香烃,一般是指分子中...
一、一些特殊反应 1、醇解反应: 卤代烃与醇钠的醇溶液反应,...
烷的取代反应主要是自由基反应。比如: Cl 2 →2Cl· CH 4 →CH 3...