
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、解沉淀溶解平衡图像题三步骤
第一步:明确图像中纵、横坐标的含义
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义
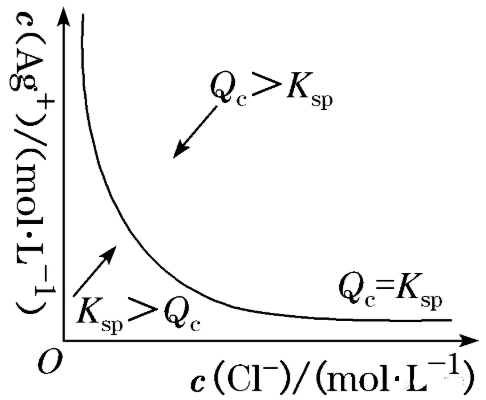
(1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。
在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp,过平衡状态,反应将逆向进行,析出沉淀。
(3)曲线下方区域的点均为不饱和溶液,此时Qc<Ksp,未平衡状态,反应将正向进行,沉淀溶解。
第三步:抓住Ksp的特点,结合选项分析判断
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
(2)从图像中找到数据,根据Ksp公式计算得出Ksp的值。
(3)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
(4)涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
二、2019高考题
12.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
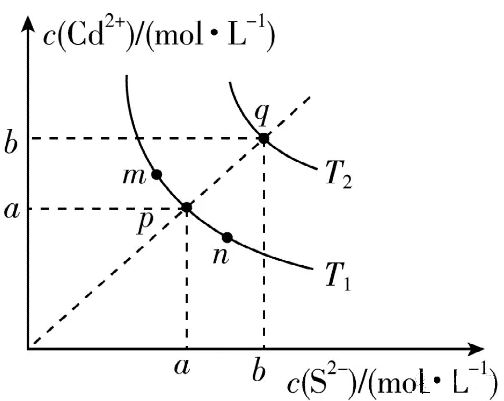
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(M)=Ksp(N)<Ksp(P)<Ksp(Q)
C.向m点的溶液中加入少量)Na2S固体,溶液组成由m沿m、p、n线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿q、p线向p方向移动
【答案】B
三、深度分析
1、素材分析
硫化镉:CdS,是一种黄色固体,几乎不溶于水,普遍在闪锌矿和纤锌矿杂质中发现,这亦是镉的主要来源。作为一种化合物,易于分离纯化。它是一种N型光电半导体材料。属六方晶格结构。
应用:硫化镉主要用作颜料。硫化镉和硒化镉用于制造光敏电阻。
2、知识迁移
选修四以AgCl为例介绍二元AB型难溶物的沉淀溶解平衡。化学反应原理就是一门用数学,物理的方法研究化学问题的学科。数学在理科的应用就是图像和变量。
Ksp是温度的函数,温度一定时是一个常数。
CdS(s) Cd2+(aq)+S2-(aq) Ksp(CdS)=c(S2-)×c(Cd2+)
Cd2+(aq)+S2-(aq) Ksp(CdS)=c(S2-)×c(Cd2+)
设:c(S2-)=x, c(Cd2+)=y,得:Ksp=xy,得到一个反比例函数,作图得下图:
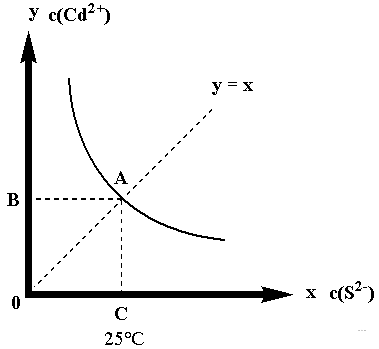
这个图像包含这几层意思:
图像把坐标第一象限划分成三个部分:
图像上方,是对应温度下的过饱和状态,Qc﹥Ksp,不稳定,平衡向沉淀方向移动,有沉淀析出;
图像下方:反过来,Qc﹤Ksp,平衡向溶解方向移动,沉淀溶解;
图像上A点,是25℃时难溶物在纯水中的平衡点,此时,B,C两点对应的坐标值是平衡时Cd2+,S2-的浓度,CdS是AB型难溶物,围成的四边形面积等于25℃的Ksp。
图像上的其它点是加入外来物质引起沉淀溶解平衡移动后再次达到平衡的点。
例如:向平衡体系中加入Na2S固体,A点将沿图像向下移动;加入稀盐酸,A点将沿图像向上移动。
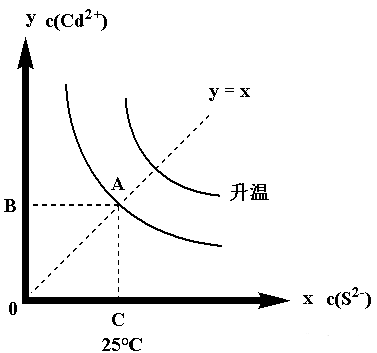
如果升高温度,一般Ksp随温度升高而增大,所以得到下面的图像:
3、就题论题
A选项:溶解度(英语:Solubility)是指定温、定压时,每单位饱和溶液中所含溶质的量;也就是一种物质能够被溶解的最大程度或饱和溶液的浓度。通常用体积摩尔浓度、质量百分浓度或“每100克溶剂能最大程度溶解的溶质质量”表示。溶解度主要取决于溶质在溶剂中的溶解平衡常数(溶度积)、温度、极性、和压强。相同溶质在不同溶剂下的溶解度不尽相同;相同溶剂在不同溶质下的溶解度不尽相同;即便是相同的溶质和溶液,在不同的环境因素下溶解度也不尽相同。
B.前面的分析已经提到:温度不变,Ksp是一个定值。图像上的每一个点都是对应条件下的平衡点,点m、p、n的Ksp值相等,几何意义就是三个点的坐标围成的四边形面积相等。
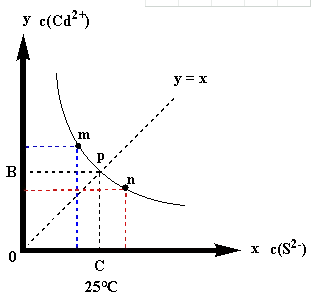
C.沉淀溶解平衡建立以后,只要不改变温度,平衡的移动就是在图像上移动。
D.改变温度,相当于图像沿y = x线平移。
总之,学习选修四化学反应原理,要善于利用数学思想分析,也就是图像和变量相结合的方法。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...