
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
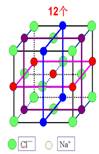
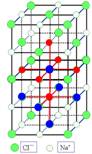
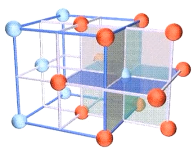
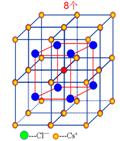
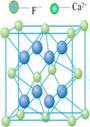
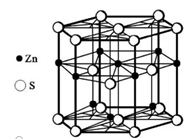
一、NaCl型(FCC点阵)
FCC布拉维点阵在高中化学内理解为“面心立方结构”
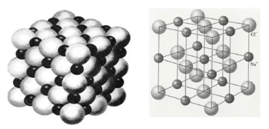
1、Na+,Cl-交替排列,每一个离子周围都有个异类离子为最近,如果将两离子视为一类,则构成面心立方结构。
2、Cl-构成面心立方点阵,Na+占据全部八面体间隙,阳离子的配位数均为
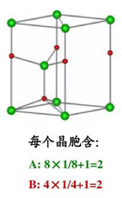
3、每个晶胞内含有个钠离子和个氯离子,化学式NaCl是表示该离子晶体中离子的个数比。
4、在每个Na+周围最近等距离的有个Na+(同层个,上层个,下层个),在每个Cl-周围最近等距离的有个Cl-。
5、属于NaCI型的还有LiF、NaF、CsF、KI、NaBr、MgO、CaS等。
6、利用率=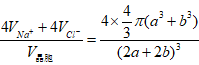
7、晶胞密度![]()
8、离子晶体中离子的配位数:是指一个离子周围最邻近的异电性离子的数目。
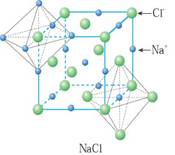
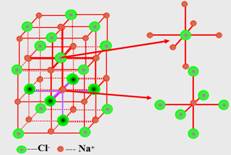
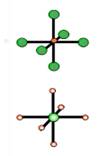
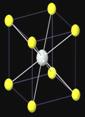
例如:在NaCl晶体中每个Na+同时吸引的6个Cl-围成的空间结构是正八面体。
与每个Na+等距紧邻的Cl-有6个;与每个Cl-等距紧邻的Na+有6个。与每个Na+等距紧邻的Na+有12个;与每个Cl-等距紧邻的Cl-有12个。每个NaCl晶胞含4个NaCl;Na+周围与每个Na+等距离紧邻的6个Cl-围成一个正八面体。



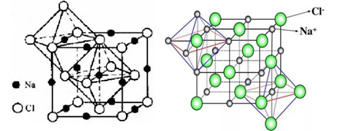
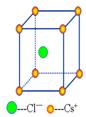
二、CsCl型(sc点阵)
sc布拉维点阵在高中化学内理解为“简单立方结构”
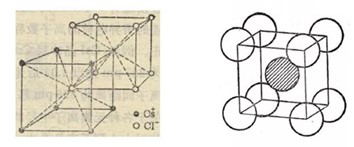
点阵:简单立方晶系:立方晶系配位数:8:8
1、Cs+,Cl-各自构成一个简单立方两组简单立方格子交叠而成。Cs+,Cl-交替排列,每一个离子周围都有个异类离子为最近,即阳离子的配位数均为。如果将两离于视为一类,则构成简单立方结构(sc)。
2、每个晶胞内含有个铯离子和个氯离子,化学式CsCl就是表示这种晶体中阴阳离子个数之比。
3、在每个Cs+周围最近等距离的有个Cs+,在每个Cl-周围最近等距离的有个Cl-。
4、属于CsCl型的还有CsBr、CsI、NH4Cl等。




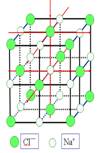
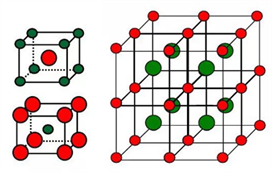
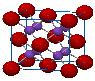
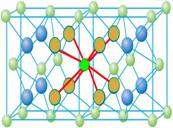
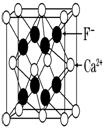
三、CaF2型(FCC点阵)
FCC布拉维点阵在高中化学内理解为“面心立方结构”

1、Ca2+的配位数为 ,F-的配位数为
2、每个晶胞内含有 个钙离子和 个氟离子,该晶胞中CaF2的单元数为4。
3、Ca2+形成面心立方堆,位于立方晶胞的顶角和面心,位于F-构成的立方体中心。F-填充在Ca2+构成的全部8个四面体空隙中,即100%填入。(注意:所有八面体空隙都未被占据,因此8个氟离子之间就形成一个“空洞”,这些“空洞”为氟离子的扩散提供了条件。所以在萤石型晶体中往往存在着离子的扩散机制)
4、属于CaF2型的还有Na2O、CaCl2、PbF2、HgF2、SrCl2等

5、上图右侧给出了氟化钙晶体结构以配位多面体相连的方式。Ca2+位于立方体中心,位于F-位于立方体顶角,立方体之间是以共棱关系相连。
6、反萤石型如:Na2O



四、立方ZnS(FCC阵型)
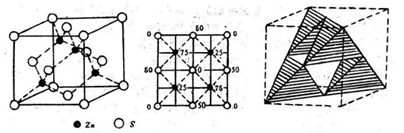
将金刚石结构中的基元置换成一对硫离子和锌离子,即得到了ZnS立方面心格子。硫离子和锌离子各自形成一面心立方格子。硫离子位于立方面心的节点位置,而锌离子交错的分布于立方体中1/8小立方体的中心。Zn2+和S2-的配位数都是4。Zn2+和S2-体对角线相切,所以距离最近的Zn2+和S2-之间的距离=![]()
五、六方ZnS型(HCP点阵)
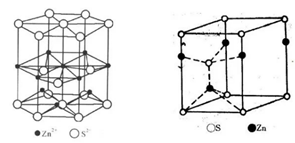
硫离子作六方最密堆积,锌离子占据1/2四面体空隙。硫离子和锌离子的配位数均为4。六方柱晶胞中ZnS的“分子数”为6。晶胞中的“分子数”为2。结构由硫离子和锌离子各一套六方格子穿插而成。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
...
Na + 、Mg 2+ 、Al 3+ 的离子半径依次减小,电荷数依次增多,可是NaCl、MgCl 2 、A...
【导读】MgO熔点为2852℃;AlO熔点为2050–2054℃。 在对比中发现MgO中Mg半径比Al半径...
一、面心立方最密堆积 面心立方最密堆之中,八面体间隙位于 棱 心和体心,如上图可知...
1. Cu 、Fe交错 一种CuFeS 2 (黄铜矿)的 四方晶系 晶胞结构如图。 如果将该晶体中的...