
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在该节的习题中经常出现以下两种图象:
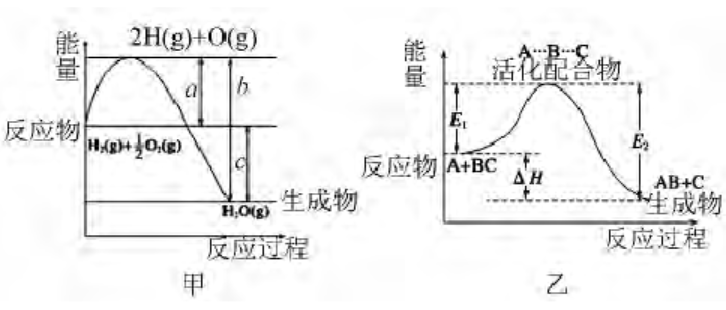
这两种图象的形式和计算方法极为相似,学生能利用它们解题,但不一定理解其真实含义,其实它们分别来自两种不同的理论.
甲图来自于理论“化学反应本质是旧键断裂,新键形成”,反应物吸收能量断键变为气态原子,然后再形成新键生成新的分子.
根据键能的概念,a 近似为 1 mol H2和 1 /2 mol O2的键能之和,b 近似为1 mol H2O 的键能,c 为该反应放出的热量,该图有多种运用,例如,
①判断反应是放热还是吸热;
②根据 c = a -b,可以进行反应热、键能之间的换算;
③直接观察出“组成元素种类和质量相同时,物质能量越高,键能一般越低”,如,甲图反应物能量高于生成物,而反应物的键能低于生成物的键能.
乙图则来自于大学教材中“过渡状态理论”,该理论认为反应物吸收能量先成为活化分子,活化分子再结合为活化配合物(或过渡态物质),活化配合物转化为生成物,并释放能量. 由于活化分子与活化配合物的能量相差极小,图中略去了活化分子. E1表示正反应的活化能,E2表示逆反应的活化能,ΔH 为反应热. 该图也有多种运用,例如,
①判断反应是放热还是吸热;
②据 ΔH = E1- E2,进反应热与活化能之间运算;
③帮助理解活化能概念,若能画出加催化剂后的能量变化图,便于理解催化剂加快反应速率的原理.

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】过渡态是反应中稍纵即逝的能量顶峰,化学键将断未断、将成未成的一种状态,中...
多数盐(如铵盐、弱酸盐)水解为吸热反应,典型的盐类水解(如FeCl水解)、酯类水解、卤代...
化学反应热力学和动力学的区别与联系如下: 一、热力学和动力学区别 1. 研究对象 热力...
一、概念梳理 中和热是指在稀溶液中,酸与碱发生中和反应生成1 mol 水时的反 应热.在2...
1.焓是什么?与什么因素有关?物质的具体焓值是否可测? 焓(符号H)是一个很难说清楚其...
...