
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子晶体中离子间的化学作用力并不限于一对正、负离子之间,而是遍及所有离子之间。以氯化钠晶体为例,设钠离子与氯离子的最短核间距为d,以1个钠离子为中心, 它与周围相离d的6个氯离子相互吸引,与相离d的12个钠离子相互排斥,又与相距
d的8个氯离子相互吸引,整个离子晶体中离子之间的静电作用力是所有这些离子的静电吸引力和排斥力的总和,由此形成晶格能(lattice energy,又称“点阵能”)的概念。晶格能(U)是指将1摩离子晶体里的正负离子(克服晶体中的静电引力)完全气化而远离所需要吸收的能量(数符为+)。例如:
NaCl(s) → Na+(g) + Cl-(g) U= 786 kJ·mol–1
表3-3给出了某些离子晶体的晶格能。从表中的数据可见,晶格能的大小与离子晶体中离子电荷、离子间核间距等因素有关。此外,晶格能也与离子晶体中离子的排列方式(结构类型)有关,(如CsCl与NaCl、CaO与Na2O的结构类型不同),将影响其晶格能的大小。
表3-3某些离子晶体的晶格能以及晶体中的离子电荷、核间距、晶体的熔点、硬度
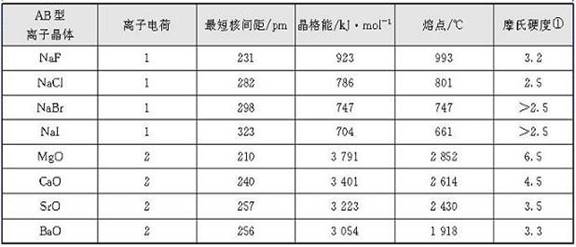
注:摩氏硬度摩氏硬度, 1822年奥地利矿物学家F. Mohs建立的固体硬度的标度,分为10级,等级越高,硬度越大, 以常见矿物的硬度划分:滑石(1)、石膏(2)、方解石(3)、萤石(4)、磷灰石(5)、正长石(6)、石英(7)、黄晶(8)、刚玉(9)、金刚石(10), 硬度大的固体可以在硬度小的固体表面划出刻痕。
晶格能越大,表明离子晶体中的离子键越稳定。一般而言,晶格能越高,离子晶体的熔点越高、硬度越大。晶格能大小还影响着离子晶体在水中的溶解度、溶解热等性质。不过,需要提醒注意的是,离子晶体在水中的溶解度与溶解热不但与晶体中离子克服晶格能进入水中吸收的能量有关,还与进入水中的离子发生水化放出的能量(水化热)有关。
晶格能不能直接测定,需用实验方法或理论方法估算,获得晶格能的方法很多,常见的方法有:
波恩-哈伯循环(Born-Haber cycle):把离子晶体中的离子变成气态离子的过程分解为若干过程之和,例如:
NaCl(s)→(a) Na(s)+1/2Cl2(g)→(b) Na(g)+ Cl(g)→(c)Na+(g)+ Cl-(g)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
天然金刚石确实容易长成八面体形状。实际上,很多立方晶系的...
由于金属原子以最紧密堆积状态排列,内部存在自由电子,所以...
金刚石晶体中,每个C原子通过sp 3 杂化,与 相邻的4个C原子形成...
离子晶体中离子间的化学作用力并不限于一对正、负离子之间,...
CO 2 中 C 原子 和 O 原子 形成 2 个双 键,而SiO 2 中 Si 原子和 O 原...
...