
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
迅速而准确地解答有关溶液的鉴别题的关键是优选鉴别试剂。优选鉴别试剂的方法是在普遍性的指导下研究特殊性,在共性中区别个性,从中找出“多功能”试剂。其优选的一般思路和规律有:
1、任选试剂鉴别物质的思路和规律
一是根据待鉴物特性加以鉴别。比如,黄绿色的气体为氯气,臭鸡蛋气味为硫化氢,火焰呈黄色是钠,能使品红褪色且加热后恢复原色的是SO2等。
二是根据待鉴物的酸碱性,或阴、阳离子的特征反应加以鉴别。比如,关于盐酸、硫酸、NaOH、Na2CO3和KNO3五种溶液的鉴别,可分析它们的阴离子,先选含有Ba2+的溶液和稀HNO3
鉴别出硫酸和Na2CO3,然后用紫色石蕊试液将盐酸、NaOH和KNO3一一鉴别出来。
三是对多种待鉴物,则可按其共性去分组,按其个性来鉴别。
2、限用一种试剂鉴别物质的规律
(1)当被鉴物阳离子相同,阴离子不同时,可加入能与这些阴离子反应产生不同颜色沉淀的阳离子。比如,只用一种试剂鉴别NaCl、Na3PO4、Na2S、NaOH、NaNO3五种无色溶液,用AgNO3溶液就能达到目的。
(2)当被鉴物阳离子相同,阴离子是挥发性酸根,或不稳定性酸根、或弱酸根离子时,可选用强酸鉴别。比如,只用一种试剂鉴别Na2S、Na2CO3、Na2SO3、Na2S2O3、Na[Al(OH)4]、NaCl六种溶液,可加入盐酸或硫酸即可。
(3)当被鉴物阳离子相同,阴离子中部分具有还原性,且采用非氧化性酸难以一次鉴别的,则应选用浓硫酸等强氧化性酸为鉴别试剂。比如,Na2S、Na2CO3、Na2SO3、Na2SO4、NaBr等溶液的鉴别,选用浓硫酸为好。
(4)当被鉴物阴离子相同,阳离子不同时,可选用强碱做鉴别试剂。倘若Zn2+盐和Al3+盐溶液同存于被鉴物之例时,难以用强碱将它们区别开来,则改用氨水即可。比如,NaOH、(NH4)2SO4、Al2(SO4)3、MgSO4、Fe2(SO4)3五种溶液可选用NaOH溶液来鉴别;又比如,NaNO3、Zn(NO3)2、Al(NO3)3、AgNO3等四种溶液的鉴别,宜用氨水来鉴别。
(5)当被鉴物中存在强酸弱碱盐或存在强碱弱酸盐时,则可选用与其能发生双水解,并能产生沉淀和气体的盐做试剂。比如,Ca(NO3)2、Al2(SO4)3、Na2SO4、H2SO4四种溶液,可选用Na2CO3溶液做试剂就能一一将它们鉴别开来。
(6)当被鉴物中含有醛基、羟基、羧基或多个羟基时,可考虑使用新制的Cu(OH)2来鉴别。
比如,乙醇、甘油、葡萄糖、乙醛、乙酸的鉴别就是用新制的Cu(OH)2来完成的。
(7)当被鉴物中含有酚羟基、C=C等官能团时,则可考虑用溴水作试剂来鉴别。比如,乙烯、氢硫酸、苯酚、AgNO3四种溶液就是用溴水来鉴别的。
(8)当被鉴物中含有醋酸盐、酚类物质,及其它一些无机物时,可用FeCl3溶液加以鉴别。比如,用FeCl3溶液可鉴别乙醇、乙酸钠、苯酚、硝酸银、碘化钾五种溶液。
(9)在水中溶解性及密度不同的有机物,可用水做鉴别试剂。比如,乙醇、CCl4和苯三种液体就可用水来鉴别。
3、不用任何试剂鉴别物质的思路
(1)利用物质的物理性质(如颜色、气味、溶解性等)直接鉴别。比如,不外加试剂鉴别浓硫酸、浓硝酸、硫酸铜溶液。即可一看颜色,溶液是蓝色者为硫酸铜溶液,二看挥发性,打开瓶盖,有白雾者为浓硝酸,无明显现象的为浓硫酸。
(2)先利用被鉴物的物理性质辨别出其中一种物质,然后用这种物质做试剂去鉴别其余物质或再用被检的物质做试剂,又去鉴别剩余物,直到一一鉴别出来为止。比如,现有①MgSO4②NaOH③FeCl3④NaCl四种溶液,不外加试剂,用最简单的方法鉴别的顺序是( )
(A)①②③④(B)②③④①(C)③②①④(D)③①④②
先看颜色检出FeCl3溶液(棕黄色),然后将FeCl3溶液做试剂去鉴别其余三种溶液,产生红褐色沉淀的是NaOH溶液,再用NaOH溶液做试剂去鉴别剩余二种溶液,产生白色沉淀的是MgSO4溶液,无白色沉淀的是NaCl溶液。
(3)若用物理性质不能直接鉴别出其中一种物质,则可将几种待鉴物编号,然后采用加热,或两两混合,根据不同现象一一鉴别出来。
比如,不另加试剂鉴别碳铵、硫铵、氯铵、苏打、小苏打五种白色固体。现用图示法如下:

专项训练
1.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,有白色沉淀生成,继续滴加沉淀消失;丁溶液滴入甲溶液中,无明显现象,据此推断丙物质是( )
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
2.有以下四组物质:
①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液
②
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液。
其中只用一种试剂(允许加热)就能将组内物质区别开的是 ( )
A.只有①③ B.只有①②③ C.只有①③④ D.全部
3.不另加试剂,也不用焰色反应,就能鉴别的溶液组是 ( )
A. Al2(SO4)3、Na2CO3、BaCl2、H2SO4
B. Na2SO4、BaCl2、K2CO3、KNO3
C. NaCl、AgNO3、CaCl2、Na2CO3
D. MgSO4、NaOH、BaCl2、NaCl
4.下列各组溶液,不用其他试剂就不能鉴别的是( )
A.FeCl3、NaNO3、Na2CO3、NaCl
B.NaOH、MgSO4、Na2CO3、NaHSO4
C.AgNO3、KNO3、KCl、NaBr
D.HCl、BaCl2、NaOH、CuSO4
5.下列各组稀溶液,不用其他试剂或试纸,仅利用溶液间的相互反应,就可以将它们区别开的是( )
A.硝酸钾 硫酸钠 氯化钙 氯化钡
B.硫酸 硫酸铝 氯化钠 氢氧化钠
C.盐酸 硫酸钠 碳酸钠 氢氧化钠
D.硫酸氢钠 氯化镁 氢氧化钡 硫酸钠
6.关于某无色溶液中所含离子的鉴别,下列判断正确的是()
A.加入AgNO3溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有Cl-存在
B.加入加Ba(NO3)2溶液,生成白色沉淀,再加稀盐酸不溶解,可确定有I-存在
C.通入C12后,溶液变为黄色,加入淀粉溶液后变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
7.下列各组溶液只需通过相互滴加就可以鉴别出来的是( )
A.NaAO2溶液和盐酸
B.NaHCO3溶液和Ca(OH)2溶液
C.浓NaOH溶液和浓NH3C1溶液
D.稀硫酸和碳酸钠溶液
8.检验某未知溶液中时否含有SO42-,下列操作最合理的是()
A.加入稀硝酸酸化的Ba(NO3)2溶液
B.加入盐酸酸化的BaCl2溶液
C.先加稀硝酸酸化,再加Ba(NO3)2溶液
D.先加盐酸酸化,再加BaCl2溶液
9.甲、乙、丙、丁分别是NaOH、MgCl2、FeSO4、NaCl四种物质的一种。若将丁溶液滴入乙溶液,发现有白色沉淀;若将丁溶液分别滴入甲、丙溶液时,无明显现象则乙物质是( )
A.MgCl2
B.NaOH
C.FeSO4
D.NaCl
10.为了区别五瓶无色溶液:HC1、A1C13、Ba(NO3)2、NaC1、Na2CO3,四位学生都没有用酒精灯,三位学生另用了试剂(甲另用了酚酞试剂乙另用了NaOH溶液丙另用了紫色石蕊试液),丁没有另用任何试剂,其中操作步骤一定最少的是( )
A.甲和丙 B.乙 C.乙和丙 D.丁
11.一瓶无色气体,可能含氧化氢、硫化氢、二氧化硫、二氧化氮、溴化氢、二氧化碳中的1种或几种,将其通入氯气中,得无色透明溶液,将该溶液分成两份,1份加入盐酸酸化的氯化钡溶液,析出白色沉淀:1份加入硝酸酸化的硝酸银溶液,也有白色沉淀生成。下面结论正确的是( )
①原气体中肯定有SO2
②原气体中可能有SO2
③原气体中肯定无H2S、HBr、NO2
④不能肯定是否含有HCl
⑤原气中肯定不含CO2
⑥原气中肯定含HCl
A.①③④ B.①④⑤ C.①③⑥ D.①②③④⑤⑥
12.某无色溶液可能含K2SO4、KCl、CuCl2、CaCl2和Na2CO3中的一种或几种,依次进行下列实验:
⑴取少量上述溶液,向其中滴加BaCl2溶液,有白色沉淀生成,过滤;
⑵向白色沉淀中加入稀盐酸,可完全溶解;
⑶向上述滤液中滴加AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸![]()
根据以上实验,可判断该溶液中肯定含有( )
A.Na2CO3 B.KCl和CaCl2
C.KCl和Na2CO3 D.K2SO4和CuCl2
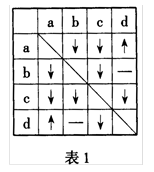
13.有A、B、C、D四瓶不同物质的溶液,它们分别是Ba(OH2)溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol·L—1)。为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如表1所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“—”表示观察不到明显现象。下列说法正确的是( )
A.A是稀硫酸
B.B可能是NA2CO3溶液
C.C是Ba(OH、)2溶液
D.D是MgCl2溶液
14.有A、B、C、D、E、F 6瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合。实验结果如表所示。表中“↓”表示生成沉淀,“↑”表示生成气,“—”表示观察不到明显现象,空格表示实验未做![]() 试推断其中F是 ( )
试推断其中F是 ( )
A.NaHCO3溶液 B.BaCl2溶液 C.MgSO4溶液 D.Na2CO3溶液
15.(8分)A、B、C、D是四种可溶于水的物质,它们分别由下列阴离子与阳离子两两组合而成,每种离子只能使用一次。
阳离子 | Na+ | NH4+ | Al 3+ | Ba2+ |
阴离子 | SO42- | OH- | CO32- | NO3- |
将A、B、C、D四种物质溶液两两混合(必要时,有的实验进行加热)其实验现象如下:
①将B溶液和C溶液混合产生白色沉淀,白色沉淀不溶于酸![]()
②将A溶液和D溶液混合产生白色沉淀,同时有气体生成![]()
③将A溶液和B溶液混合产生白色沉淀,同时有气体生成![]()
那么A、B、C、D分别为 、 、 、 ![]()
参考答案:
1、D 2、D 3、A 4、A 5、B 6、C 7、AD 8、D 9、B 10、A 11、A 12、A 13、C 14、A
15.(8分)A(NH4)2CO3 B.Ba(OH)2,C是Na2SO4 D是Al(NO3)3(每个2分)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
注意: 铂丝要使用稀盐酸清洗,而不是稀硫酸...
...
...
H 2 O是一种最常见的化学试剂,它无色无味,但在物质鉴别中却...
溶液中存在几种离子,而又不能使用任何试剂的检验(简称零鉴...