
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
CuH
1.制备:4Cu2++ 3H2PO2- + 6H2O = 4CuH + 3PO43- + 14H+
2.性质:红色沉淀。它受热就分解为金属铜和氢气。
3.和浓盐酸反应:CuH + xHCl = H2 + [CuClx]1-x+ (1-x)H+
NaH
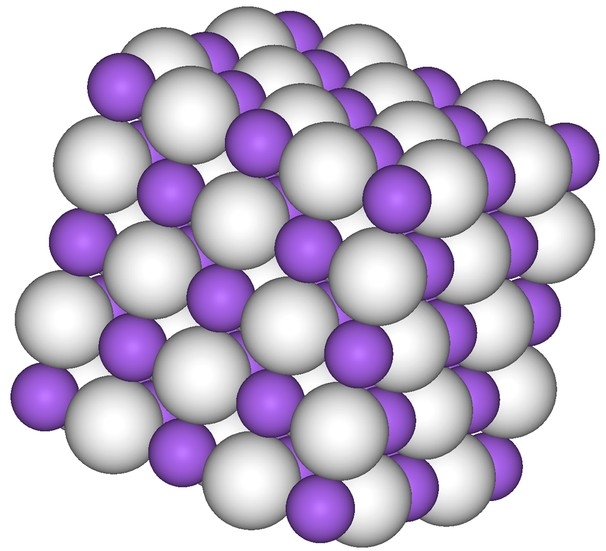
1.2Na+H2=NaH(高温)
2.红色沉淀。它受热就分解为金属铜和氢气。
3.与液氨反应:NaH+NH3→NaNH2+H2↑
易与水反应:NaH+H2O→NaOH+H2
4.LiH和NaH性质类似
AlH3,单个分子难以存在,一般以((AlH3)n)存在,也存在二聚物。
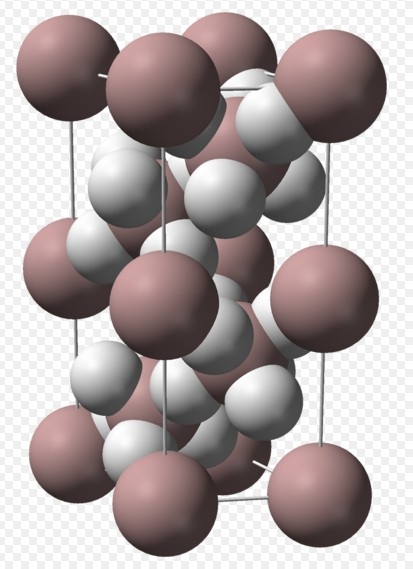
1.制备方法:
3LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
2LiAlH4 + BeCl2 → 2 AlH3 + LiBeH2Cl2
2LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2
2LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
2、性质:主要用于有机化学反应的强还原剂
如:4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
LiAlH4:离子化合物,属于离子晶体.
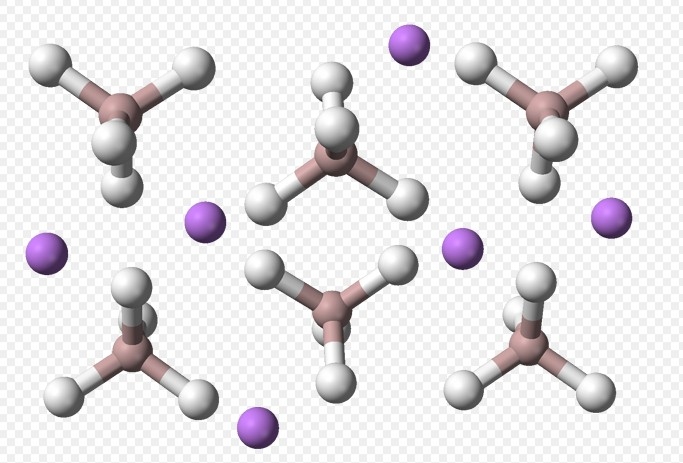
1.制备:LiH + Al + 2H2 → L iAlH4,NaAlH4 + L iCl→ L iAlH4 + NaCl(在乙醚环境下)
2.LiAlH4 + 2H2O → L iAlO2 + 4H2,LiAlH4 + 4H2O → L iOH + Al(OH)3 + 4H2
LiAlH4的乙醚或四氢呋喃溶液能同氨猛烈作用放出氢气:
2L iAlH4 + 5NH3 → [LiAlH(NH2)2]2NH + 6H2
当氨的量不足时,发生如下反应:
LiAlH4 + 4NH3 → L iAl(NH2)4 + 2H2
NH3/LiAlH4比值更小时,则氨中的三个氢都可被取代:
LiAlH4 +4NH3 → L i[Al(NH2)4]+3H2
大多数金属氢化物可以看作氢原子镶嵌在金属原子的缝隙中,因此NaH可以写成NaxHy,x往往大于y。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。钠(Na)的密度为0.97g/cm,而钾(K)的密度为0.862g/cm。碱金属族从上到下,随着质子...
1943年,彼时的中国正处于对日抗战的艰苦岁月。那一年,中国化学工程师学会一致同意,...
因为在钾的化合物中往往混有一些钠的化合物(不易分离),在进行焰色反应时,由于钠元...
在有关原子 —分子概念的争论中,一直注意着理论的发展却从不介入争论的本生,在以化...
为什么碳酸钠溶于水放热,而碳酸氢钠溶于水却吸热呢? 首先, 我们得清楚碳酸钠与碳酸...
氢几乎能与除稀有气体外的元素结合成二元化合物,这些二元化合物统称为氢化物。 1.氢...