
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
配平氧化还原反应方程式的基本方法相同,关键是针对具体的反应往往有不同的配平技巧。本文介绍几种常用的配平技巧。
一、全变左边配
氧化剂、还原剂中某元素化合价全变的反应,一般从反应物着手配平。
如91年高考题:Pt+HNO3+HCl-H2PtCl6+NO↑+H2O
分析:还原剂Pt和氧化剂HNO3中n(的化合价全变),可从反应物着手先确定Pt和HNO3的系数。

确定了Pt和HNO3的系数分别为3和4之后,再用观察法配平其余物质的系数,得到:
3Pt+4HNO3+18HCl=3H2PtCl6+4NO↑+8H2O
二、自变右边配
自身氧化还原反应(包括同一物质中同种元素变价和不同种元素变价两种情况),一般从生成物着手较好。
如92年高考试题:(NH4)2PtCl6→Pt+NH4Cl+HCl↑+N2↑
分析:该反应是(NH4)2PtCl6中n(与)Pt之间发生的自身氧化还原反应,可从生成物着手,先确定Pt和N2的系数。

确定了Pt和N2的系数分别为3和2之后,再用观察法配平其余物质的系数,可得:
3(NH4)2PtCl6==3Pt+2NH4Cl+16HCl↑+2N2↑
三、部分变两边配
如85年高考题:Zn+HNO3——Zn(NO3)2+NH4NO3+H2O
分析:该反应中HNO3部分被还原,其系数应为变与不变之和。对于这类部分氧化还原反应,宜从反应物和生成物同时着手,先确定Zn和NH4NO3的系数。

确定了Zn和NH4NO3的系数分别为4和1之后,再用观察法配平Zn(NO3)2、HNO3、H2O的系数依次为4、10、3。
四、多变要整体配
如89年高考题:Cu2S+HNO3──Cu(NO3)2+NO↑+H2SO4+H2O
分析:Cu2S中的Cu和S同时失去电子,应从反应物着手,把Cu2S当作一个整体来处理。

确定了Cu2S和NO的系数分别为3和10之后,再用观察法确定H2SO4、Cu(NO3)2、HNO3、H2O的系数依次为3∶6、22、8。
又如:P4+CuSO4+H2O——Cu3P+H3PO4+H2SO4
分析:Cu和部分的P4得到电子后形成一个整体Cu3P,应从生成物着手,先确定Cu3P和磷酸的系数。

确定了Cu3P和H3PO4的系数分别为20和24之后,再用观察法配平P4、CuSO4、H2SO4、H2O的系数依次为11、60、60、96。
五、化台价难断用整体总价法配
如1991年河南省化学奥林匹克竞赛决赛试题:Fe3P+HNO3——Fe(NO3)3+NO↑+H3PO4+H2O
分析:Fe3P中元素化合价难以断定,以整体记为[Fe3P]0,则:

确定了Fe3P和NO的系数分别为3和14之后,再用观察法确定H3PO4,Fe(NO3)3、NO、HNO3、H2O的系数依次为3、9、14、41、16。
又如:S+Ca(OH)2——CaS5+CaS2O3+H2O
分析:根据化合价规则把CaS5中S的化合价总值记为[S5]-2,CaS2O3中S的化合价总值记为[S2]+4,则:

确定了CaS5和CaS2O3的系数分别为2和1之后,再用观察法确定S、Ca(OH)2、H2O的系数依次为12、3、3。
六、有机氧化还原反应用整体总价法配
如86年高考题:K2Cr2O7+H2C2O4+H2SO4──K2SO4+Cr2(SO4)3+CO2↑+H2O
分析:有机物中元素化合价可依H显+1价,O显-2价,根据化合价规则把H2C2O4中[C2]化合价总值记为[C2]+6。K2Cr2O7中[Cr2]记为[Cr2]+12,则:

K2Cr2O7和H2C2O4的系数分别为1和3,再用观察法配平其余物质CO2、K2SO4、Cr2(SO4)3、H2SO4、H2O的系数依次为6、1、1、4、7。
七、复杂问题用“1+n”法
元素价态变化在三种或三种以上,并分散在三种或三种以上物质中又有含氧化合物参加的氧化还原反应,按照前面介绍的方法实在难以配平时,可采用“1+n”法。
如92年全国化学竞赛题:CUSO4+FeS2+H2O——Cu2S+FeSO4+H2SO4
分析:将含有氧元素的复杂物质CuSO4系数定为1,较简单的物质系数定为n,FeS2、H2O均可。根据质量守恒定律,在不考虑氧原子个数的前提下,调整其它物质的系数,得到:
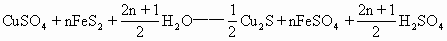
根据氧原子守恒列方程,求出n(值)。
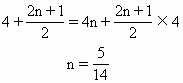
将n值代入上式,并将系数化为整数即得:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
下面几个反应,供同学们练习。
(1)Cu(IO3)2+KI+H2SO4──CuI2+I2+K2SO4+H2O
(2)Fe(CrO2)2+Na2O2──Na2CrO4+Fe2O3+Na2O
(3)Fe3C+HNO3(浓)──Fe(NO3)3+NO2↑+CO2↑+H2O
(4)C7H8+KMnO4+H2SO4──C7H6O2+K2SO4+MnsO4+H2O
(5)KI+KIO3+H2S──I2+K2SO4+H2O
(6)KNO3+C+S——K2S+CO2+N2
答案:
(1)1,12,6,1,6,6,6;
(2)2,7,4,1,3;
(3)1,22,3,13,1,11;
(4)5,6,9,5,3,6,14;
(5)1,5,3,3,3,3;
(6)2,3,1,1,3,1。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。说明: 1.不同于大学所说的“氧化数”,高中所学的“化合价”只是一个工具,是为了更...
氧化还原反应的很多规律,如化合价有升必有降、电子有得必有失,而且升降总数相等、得...
配平氧化还原反应方程式的基本方法相同,关键是针对具体的反应往往有不同的配平技巧。...
氧化性、还原性的强弱主要取决于物质本身得失电子的难易程度而不取决于得失电子数目的...
得失电子守恒是氧化还原反应的核心,根据这一原理,既可配平氧化还原方程式,又可进行...
1 问题的提出 “氧化还原反应”在中学化学知识中占据着关键性位置,是电化学的基础,...