
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
按照现行中学化学教材必修本第二册,实验[3-1]制备Fe(OH)2,往往得不到理想的白色絮状沉淀,对此实验曾有很多改进措施,但其操作方法繁琐或者实验条件过于苛刻而难以推广。在教学中,我们通过多次探索,采用电解法制备Fe(OH)2,方法简便,现象明显。
一、实验用品:
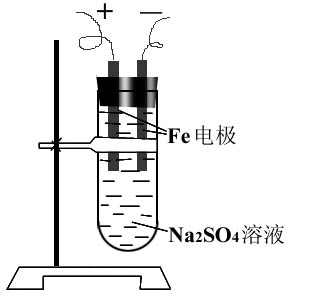
Na2SO4溶液、稀盐酸、蒸馏水、铁电极(两支)导线、低压电源、试管(25mm×100mm)、铁架台、三孔橡皮塞。
二、实验装置(如图)
三、实验原理:
用铁作电极,Na2SO4溶液作电解液,电极反应式为: 阴极:2H2O + 2e === H2↑ + 2OH-
阳极:Fe -2e === Fe2+
阴极附近产生的OH-与阳极溶解产生的Fe2+结合生成Fe(OH)2。
Fe2+ + 2OH-=== Fe(OH)2
由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀。
四、实验步骤:
1.取Na2SO4溶液30mL,加热煮沸去除溶液中的溶解氧。
2.将两铁电极浸入稀盐酸中,除去电极表面的氧化层,然后用蒸馏水冲洗干净。
3.按如图所示装置接通直流电源,将电压调至4~6V。
五、实验现象: 通电后即看到阴极有大量气体产生,同时溶液中出现大量絮状白色沉淀。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。常考错误变换分析 错误实验图示解读 大π键又叫离域π键,何谓“离域”,顾名思义,“...
一、检验 1.Fe 3+ ①观察法:溶液呈棕黄色 ②KSCN溶液:加入KSCN或其它可溶性硫氰化...
实验现象: ①镁带剧烈燃烧,放出大量的热,并发出耀眼的白光,氧化铁与铝粉在较高温...
一、铝与氧气的反应(熔点问题) 实验操作:用坩埚钳夹持一片薄铝片,在酒精灯火焰上...
【原理】根据废液中银的存在形式大致可以用以下几种方法。 (1)对于可溶性银盐(如Ag...
...