
|
学习小专题 |

|
学习小专题 |
 [元素化合物] 元素及其化合物考点荟萃 作者:化学自习室 来源:未知 日期:2020-04-06 15:40:17 点击:1242 所属专题:元素及其化合物
[元素化合物] 元素及其化合物考点荟萃 作者:化学自习室 来源:未知 日期:2020-04-06 15:40:17 点击:1242 所属专题:元素及其化合物
一、氯气的三大常考点 (1)1 mol Cl 2 参加反应,转移电子数不一定为2 N A 。如反应Cl 2 +2NaOH===NaCl+NaClO+H 2 O,1 mol Cl 2 参加反应,转移电子数目为 N A 。 (2)氯气作为氧化剂使用,如将Fe 2+ 氧化为Fe 3+ 。 (3)实验室制Cl 2 ,除了用MnO 2 和浓盐酸反应外,还...
 [元素化合物] 元素化合物易错点辨析 作者:化学自习室 来源:未知 日期:2020-02-16 15:48:45 点击:791 所属专题:元素化合物 易错点
[元素化合物] 元素化合物易错点辨析 作者:化学自习室 来源:未知 日期:2020-02-16 15:48:45 点击:791 所属专题:元素化合物 易错点
1.碱金属元素原子半径越大,熔点越高,单质的活泼性越大 错误,熔点基本是随着原子半径增大而递减 2.硫与白磷皆易溶于二硫化碳、四氯化碳等有机溶剂,有机酸则较难溶于水 错误。有机酸是否难溶于水,主要看有机酸的相对分子质量。相对分子质量越大,有机酸越难溶于水。如CH...
 [元素化合物] 必须关注的生产和生活中的常见物质 作者:化学自习室 来源:未知 日期:2020-02-28 10:30:40 点击:952 所属专题:物质性质与用途
[元素化合物] 必须关注的生产和生活中的常见物质 作者:化学自习室 来源:未知 日期:2020-02-28 10:30:40 点击:952 所属专题:物质性质与用途
1.熟记常见物质的俗名及化学式 (1)明矾:KAl(SO 4 ) 2 ·12H 2 O(2)胆矾、蓝矾:CuSO 4 ·5H 2 O(3)绿矾:FeSO 4 ·7H 2 O (4)钡餐、重晶石:BaSO 4 (5)孔雀石(铜绿):Cu 2 (OH) 2 CO 3 (6)水晶、石英:SiO 2 (7)纯碱、苏打:Na 2 CO 3 (8)磁性氧化铁:Fe 3 O 4 2.熟...
 [元素化合物] 铜及其化合物性质总结 作者:化学自习室 来源:未知 日期:2020-01-03 15:42:09 点击:10319 所属专题:铜及其化合物
[元素化合物] 铜及其化合物性质总结 作者:化学自习室 来源:未知 日期:2020-01-03 15:42:09 点击:10319 所属专题:铜及其化合物
铜是人类最早发现和应用的金属之一,紫红色,密度大,熔沸点高,有很好的延展性、导热、导电性。 晶体为面心立方结构。化合价通常为+2,也有+1,焰色反应为绿色;原子结构有四个电子层,电子层:K、L、M、N层分别有2、8、18、1个电子,电子排布式为1s 2 2s 2 2p 6 3s 2 3p...
 [元素化合物] 高考热点——钛元素的性质总结 作者:化学自习室 来源:未知 日期:2020-01-03 15:40:52 点击:3071 所属专题:钛及其化合物 钛
[元素化合物] 高考热点——钛元素的性质总结 作者:化学自习室 来源:未知 日期:2020-01-03 15:40:52 点击:3071 所属专题:钛及其化合物 钛
1.钛单质 :与浓盐酸和浓硫酸反应,均生成氢气: (1)2Ti + 6HCl(浓) = 2TiCl 3 +3H 2 ↑ (2)2Ti +3H 2 SO 4 (浓) = Ti 2 (SO 4 ) 3 +3H 2 ↑ 2.单质钛的制备 : (1)FeTiO 3 加H 2 SO 4 处理,同时加入铁屑,目的是防止Fe 2+ 被氧化: FeTiO 3 +2H 2 SO 4 = TiOsO ...
 [元素化合物] 银及其化合物性质总结 作者:化学自习室 来源:未知 日期:2020-01-03 15:24:30 点击:5232 所属专题:银及其化合物
[元素化合物] 银及其化合物性质总结 作者:化学自习室 来源:未知 日期:2020-01-03 15:24:30 点击:5232 所属专题:银及其化合物
1. 银单质 ( 47 Ag)是第五周期I b 族元素,在自然界有游离态的银。银的活动性在氢之后,在电化学中,Ag是活性电极,在阳极放电:Ag-e - =Ag + 。 Ag 2 O对热不稳定,加热到时完全分解: 2Ag 2 O 4Ag+O 2 ↑。 乙醇在单质Ag或Cu催化下,可被氧化成乙醛,其催化原理是: 4A...
 [元素化合物] 锰及其化合物的性质归纳 作者:化学自习室 来源:未知 日期:2020-01-03 15:19:22 点击:8834 所属专题:锰及其化合物 高锰酸钾
[元素化合物] 锰及其化合物的性质归纳 作者:化学自习室 来源:未知 日期:2020-01-03 15:19:22 点击:8834 所属专题:锰及其化合物 高锰酸钾
锰( 25 Mn)位于第四周期第ⅦB族,价电子构型为3d 5 4s 2 ,软锰矿主要成分为MnO 2 ,价态以+2、+4、+6、+7为最为常见,是活泼金属。 一、Mn 2+ 的性质 Mn 2+ 价电子构型为较稳定的3d 5 半充满结构,因此Mn 2+ 是锰的最稳定状态。在水溶液中呈粉红色,多数盐易溶。Mn...
 [元素化合物] 高考涉及到的铬及其化合物的性质 作者:化学自习室 来源:未知 日期:2020-01-03 15:09:31 点击:3074 所属专题:铬及其化合物 重铬酸钾
[元素化合物] 高考涉及到的铬及其化合物的性质 作者:化学自习室 来源:未知 日期:2020-01-03 15:09:31 点击:3074 所属专题:铬及其化合物 重铬酸钾
24 Cr是第四周期第ⅥB族金属元素,铬的价电子构型为3d 5 4s 1 ,以+3、+6两种价态化合物最为重要。 铬单质是最硬的金属,与铁、镍能组成不锈钢。可用铝热法由Cr 2 O 3 制备金属铬:Cr 2 O 3 +2Al 2Cr+Al 2 O 3 。 含Cr 3+ 的溶液呈绿色,铬酸钾(K 2 CrO 4 )为黄色,重...
 [元素化合物] 化学方程式及离子方程式总汇 作者:化学自习室 来源:未知 日期:2019-09-16 07:34:23 点击:4843 所属专题:化学方程式 离子反应方程式
[元素化合物] 化学方程式及离子方程式总汇 作者:化学自习室 来源:未知 日期:2019-09-16 07:34:23 点击:4843 所属专题:化学方程式 离子反应方程式
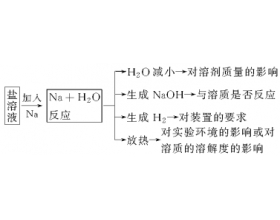
一、钠及其化合物有关反应方程式 (一)与金属钠有关的反应方程式 1.钠与氧气在常温下反应:4Na+O 2 ===2Na 2 O .钠在氧气中燃烧:2Na+O 2 Na 2 O 2 2.钠在氯气中燃烧:2Na+Cl 2 2NaCl 3.钠与硫粉研磨发生轻微爆炸:2Na+S Na 2 S 4.钠与水反应:2Na+2H 2 O===2NaOH+H 2...
 [元素化合物] 复习讲义:全面认识氯及其化合物 作者:淮畔化学 来源:未知 日期:2019-09-12 11:00:11 点击:18695 所属专题:氯及其化合物
[元素化合物] 复习讲义:全面认识氯及其化合物 作者:淮畔化学 来源:未知 日期:2019-09-12 11:00:11 点击:18695 所属专题:氯及其化合物
近三年高考试题中,氯气及其化合物,一直是高考命题的重点内容,Cl 2 的实验室制法也是命题的重点,它作为气体制备实验经常出现在实验题中。 另外,在电化学方面,氯碱工业作为电解的重要应用之一,备考时应重点关注。应以氯碱工业原理为基点,从电解饱和食盐水的微观分析出...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...