
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑i] 浓度化学平衡常数与分压平衡常数关系及应用 作者:化学自习室 来源:未知 日期:2019-12-25 11:15:17 点击:17687 所属专题:化学平衡常数 分压平衡常数
[注解与辨疑i] 浓度化学平衡常数与分压平衡常数关系及应用 作者:化学自习室 来源:未知 日期:2019-12-25 11:15:17 点击:17687 所属专题:化学平衡常数 分压平衡常数
《无机化学》化学平衡一章告诉我们:对于可逆反应aA + b B dD + eE在一定温度下达到平衡时,反应物、生成物之间存在如下关系 则Kc被称为平衡常数,它是用平衡浓度来量度的。对于气相反应,我们还可以用平衡分压Kp,来表示对于气相反应aA(g) +bB(g) dD(g) +eE(g)而言 通过克拉...
 [注解与辨疑i] 化学反应速率中几个重要的拓展概念 作者:化学自习室 来源:未知 日期:2019-12-18 08:24:05 点击:3008 所属专题:化学反应速率 速率常数 基元反应 活化能
[注解与辨疑i] 化学反应速率中几个重要的拓展概念 作者:化学自习室 来源:未知 日期:2019-12-18 08:24:05 点击:3008 所属专题:化学反应速率 速率常数 基元反应 活化能
在高中阶段研究外界条件对化学反应速率的影响时,教材中出现了基元反应、活化能、反应速率常数等概念。那我们在日常的教学中,如何把握教学的深广度呢? 一、基元反应 原高中教材在讨论反应速率存在一些问题: ⑴学生不了解化学反应是如何进行的,比如 H 2 +Cl 2 =HCl...
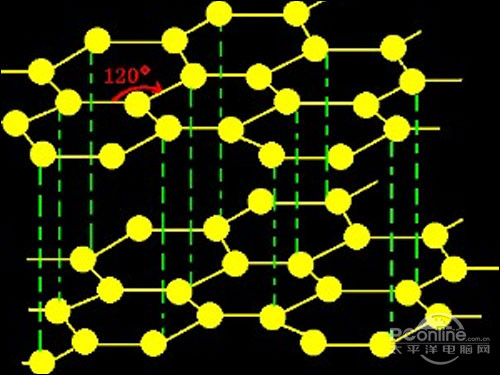 [注解与辨疑i] 如何理解勒沙特列原理中的“压强” 作者:化学自习室 来源:未知 日期:2019-11-27 18:31:33 点击:2685 所属专题:勒沙特列原理盲区
[注解与辨疑i] 如何理解勒沙特列原理中的“压强” 作者:化学自习室 来源:未知 日期:2019-11-27 18:31:33 点击:2685 所属专题:勒沙特列原理盲区
一、问题的提出 勒夏特列原理是化学平衡中的重要经验原理,也是高中阶段学生和教师解决化学平衡问题的主要依据。虽然有研究者认为勒夏特列原理只是经验性总结,只能定性判断,并且在实际应用中有条件限制(包括“均相、封闭体系、只允许一个因素改变等”),不建议向学...
 [注解与辨疑i] 为什么加入氯化钾晶体使三价铁离子和硫氰根离子混合液颜色变浅? 作者:化学自习室 来源:未知 日期:2019-10-06 18:23:10 点击:1828 所属专题:氯化铁
[注解与辨疑i] 为什么加入氯化钾晶体使三价铁离子和硫氰根离子混合液颜色变浅? 作者:化学自习室 来源:未知 日期:2019-10-06 18:23:10 点击:1828 所属专题:氯化铁
Fe 3+ +(n)SCN - Fe(SCN)n (3-n) 从Fe 3+ 和SCN - 反应的离子方程式可以看出,K + 和Cl - 都没有参加反应,加入KCl不会引起Fe 3+ /SCN - 平衡的移动。事实上,加入NaNO 3 、CH 3 COONH 4 、Na 2 SO 4 或KI等这些与平衡无关的强电解质晶体,都会使Fe 3+ /SCN - 溶...
 [注解与辨疑i] 有关酸碱性概念的归纳 作者:伍伟夫 来源:化学原理补正 日期:2021-08-16 12:06:00 点击:4502 所属专题:溶液酸碱性
[注解与辨疑i] 有关酸碱性概念的归纳 作者:伍伟夫 来源:化学原理补正 日期:2021-08-16 12:06:00 点击:4502 所属专题:溶液酸碱性
“酸碱性”概念是一个十分重要的,且有多重含义的化学概念。为了使学生能较好地区分“物质酸碱性”与“溶液酸碱性”概念上的不同,有必要在教学中归纳和总结出如下几点,以便让学生对其能有一个更为清楚的认识。 一、物质的酸碱性 酸与碱恐怕是人们最早认识的两类化学物...
 [注解与辨疑i] 如何定量理解越弱越水解? 作者:化学自习室 来源:未知 日期:2019-06-27 15:19:22 点击:2086 所属专题:盐类水解规律 水解平衡常数
[注解与辨疑i] 如何定量理解越弱越水解? 作者:化学自习室 来源:未知 日期:2019-06-27 15:19:22 点击:2086 所属专题:盐类水解规律 水解平衡常数
盐类的水解规律中有“谁弱谁水解,越弱越水解”. 在课本“科学视野”栏目中介绍了盐的水解常数,但很多学生却不够重视,殊不知其推导过程能帮助我们更深入的去理解水解规律. 例1 在25 ℃时,等浓度的NaF 溶液pH=a 和NaCN 溶液的pH=b,则a b(填“>”“<”或“=”)(数...
 [注解与辨疑i] 平衡向体积增大方向移动,混合气体平均相对分子质量一定减小吗? 作者:化学自习室 来源:未知 日期:2019-06-26 10:16:57 点击:1421 所属专题:平衡移动量变
[注解与辨疑i] 平衡向体积增大方向移动,混合气体平均相对分子质量一定减小吗? 作者:化学自习室 来源:未知 日期:2019-06-26 10:16:57 点击:1421 所属专题:平衡移动量变
对于全是气体的化学反应,平衡向扩体方向移动,由于气体的总质量不变,气体的物质的量增大,混合气体的平均相对分子质量将减小. 而对于不全是气体的反应,平衡向扩体方向移动,由于气体的总质量和总物质的量均发生改变,混合气体的平均相对分子质量要具体分析. 例如可逆反应C(s)+H...
 [注解与辨疑i] 平衡向正反应方向移动,生成物的百分含量变化一定增大吗? 作者:化学自习室 来源:未知 日期:2019-06-26 10:09:30 点击:3970 所属专题:平衡移动量变
[注解与辨疑i] 平衡向正反应方向移动,生成物的百分含量变化一定增大吗? 作者:化学自习室 来源:未知 日期:2019-06-26 10:09:30 点击:3970 所属专题:平衡移动量变
若是通过改变压强或温度使平衡向正反应方向移动,则生成物的百分含量一定会增大. 若平衡是由于加入反应物而发生移动,如反应2SO 2 (g)+O 2 (g) 2SO 3 (g)达平衡状态时,保持其它条件不变,加入一定量的SO 2 (或O 2 ),则达新平衡时,SO 3 的百分含量可能增大也可能减小,这...
 [注解与辨疑i] 平衡发生移动时,各反应物转化率的变化分析 作者:化学自习室 来源:未知 日期:2019-06-26 10:05:37 点击:2013 所属专题:平衡移动量变
[注解与辨疑i] 平衡发生移动时,各反应物转化率的变化分析 作者:化学自习室 来源:未知 日期:2019-06-26 10:05:37 点击:2013 所属专题:平衡移动量变
转化率是指在一定条什下,某可逆反应达到平衡时,某反应物转化的浓度占该反应物起始浓度的百分率. 转化率=(C 始 -C 终 )÷ C 始 × 100% 因此,凡是能引起化学平衡移动的因素,都可使某反应物的转化率发生变化,至于平衡发生移动时反应物的转化率如何变化,则要根据 具体反应进...
 [注解与辨疑i] 有气体参加(或生成)的平衡体系中, 再充入气体对平衡的影响分析 作者:化学自习室 来源:未知 日期:2019-06-26 10:00:58 点击:2174 所属专题:惰性气体影响
[注解与辨疑i] 有气体参加(或生成)的平衡体系中, 再充入气体对平衡的影响分析 作者:化学自习室 来源:未知 日期:2019-06-26 10:00:58 点击:2174 所属专题:惰性气体影响
1.加入与反应相关的气体 (1)在容积恒定的密闭容器中,反应已达平衡,此时只要充入反应体系中任何一种气体,也就是改变反应体系中任何一种气体的浓度, 平衡都会发生移动.平衡移动的方向应从浓度对平衡的影响来判断,而不应从压强的影响去判断. 例如:2SO 2 (g)+O 2 (g) 2SO...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。什么是能垒、活化能?二者有什么区别? 1、能垒 活化分子含有的能参加化学反应的最低...
1.无论是用某一反应物表示还是用某一生成物表示,由于Δ C 是取浓度变化的绝对值,因...
在一个恒温恒容的密闭容器里,充入2mol SO 2 和1mol O 2 ,发生如下反应并建立化学平...
...
一、人物简介: 阿伦尼乌斯·斯万特·奥古斯特(1859年2月19日~1927年10月2日)瑞典物...
本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。 本题...
工业生产中适宜生产条件的选择原则 : (1)从化学反应速率分析:既不能过快,也不能...
化学反应总是在一定条件下进行。化学反应速率和化学平衡从两个角度诠释了反应进行的两...