
|
学习小专题 |

|
学习小专题 |
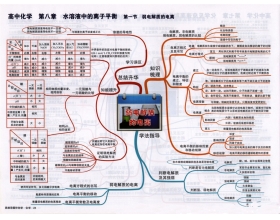 [导学与精要j] 电离平衡复习之思维导图 作者:化学自习室 来源:未知 日期:2018-05-30 16:52:03 点击:2045 所属专题:电离平衡
[导学与精要j] 电离平衡复习之思维导图 作者:化学自习室 来源:未知 日期:2018-05-30 16:52:03 点击:2045 所属专题:电离平衡
...
 [化学反应原理综合] 溶液中离子平衡之思维导图 作者:张超鹏 来源:未知 日期:2016-12-19 17:36:05 点击:5820 所属专题:电解质溶液
[化学反应原理综合] 溶液中离子平衡之思维导图 作者:张超鹏 来源:未知 日期:2016-12-19 17:36:05 点击:5820 所属专题:电解质溶液
...
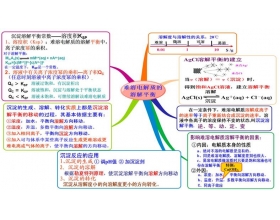 [导学与精要j] 难溶电解质的溶解平衡之思维导图 作者:舒次恩 来源:未知 日期:2016-12-19 10:44:36 点击:2588 所属专题:溶解平衡
[导学与精要j] 难溶电解质的溶解平衡之思维导图 作者:舒次恩 来源:未知 日期:2016-12-19 10:44:36 点击:2588 所属专题:溶解平衡
...
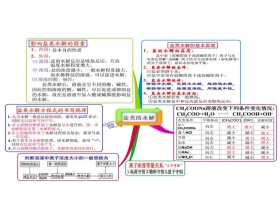 [导学与精要j] 盐类的水解之思维导图 作者:陈螯 来源:未知 日期:2016-12-19 10:44:06 点击:6515 所属专题:盐类水解
[导学与精要j] 盐类的水解之思维导图 作者:陈螯 来源:未知 日期:2016-12-19 10:44:06 点击:6515 所属专题:盐类水解
...
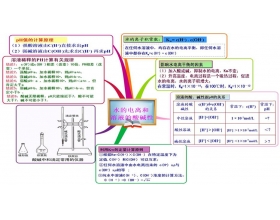 [导学与精要j] 水的电离和溶液的酸碱性之思维导图 作者:林夕 来源:未知 日期:2019-07-30 08:24:43 点击:6207 所属专题:水的电离 溶液酸碱性
[导学与精要j] 水的电离和溶液的酸碱性之思维导图 作者:林夕 来源:未知 日期:2019-07-30 08:24:43 点击:6207 所属专题:水的电离 溶液酸碱性
...
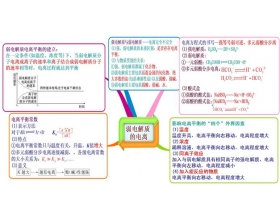 [导学与精要j] 弱电解质的电离平衡之思维导图 作者:吴乾环 来源:未知 日期:2018-07-19 15:59:58 点击:5667 所属专题:电离平衡
[导学与精要j] 弱电解质的电离平衡之思维导图 作者:吴乾环 来源:未知 日期:2018-07-19 15:59:58 点击:5667 所属专题:电离平衡
...
 [导学与精要j] 通俗讲义:醋酸是张银行卡 作者:朱康 来源:未知 日期:2020-03-05 10:56:41 点击:1585 所属专题:电离平衡
[导学与精要j] 通俗讲义:醋酸是张银行卡 作者:朱康 来源:未知 日期:2020-03-05 10:56:41 点击:1585 所属专题:电离平衡
两瓶体积相同的溶液,一瓶醋酸,一瓶盐酸,pH同为2.5,即[H + ]同为约0.003mol/L。盐酸是强电解质,完全电离,[H + ]是这个数字,[HCl]也是这个数字。 醋酸是弱电解质,少部分电离,聚多离少。 CH 3 COOH≒ CH 3 COO - +H + 与这个可逆电离相应的平衡叫作电离平衡。因...
 [导学与精要j] 通俗讲义:水解反应及其原理 作者:安勃 来源:未知 日期:2020-03-05 11:16:22 点击:19424 所属专题:盐类水解 水解反应
[导学与精要j] 通俗讲义:水解反应及其原理 作者:安勃 来源:未知 日期:2020-03-05 11:16:22 点击:19424 所属专题:盐类水解 水解反应
一.水解的前提 水解反应首先是将水分子一解为二,否则水解无从谈起。 H-OH被解离成H原子和-OH,或H + 和OH - 。 不可能解离成O原子。那不是水解,那是电解。 水解主体亦一解为二,并选择性结合H或OH。 二.从“没的挑”到“有的挑” 很熟悉Cl 2 与H 2 O的反应。 Cl 2 +...
 [导学与精要j] 关于电离平衡的学习方法 作者:程波 来源:未知 日期:2016-02-02 20:45:07 点击:6962 所属专题:电离平衡
[导学与精要j] 关于电离平衡的学习方法 作者:程波 来源:未知 日期:2016-02-02 20:45:07 点击:6962 所属专题:电离平衡
电离平衡是中学化学的基础理论之一,知识点多,灵活性强,理解能力要求高,许多同学学习时感到比较困难。在学习中采...
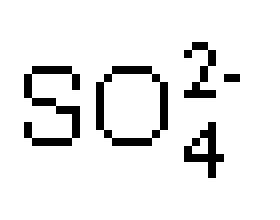 [导学与精要j] 离子浓度大小的比较专题 作者:程波 来源:未知 日期:2016-01-07 20:41:54 点击:23332 所属专题:离子浓度大小比较
[导学与精要j] 离子浓度大小的比较专题 作者:程波 来源:未知 日期:2016-01-07 20:41:54 点击:23332 所属专题:离子浓度大小比较
一、离子浓度大小的比较 这类问题包括一种物质的溶液和两种物质的溶液。具体分析问题和解题是要先整体,后局部;先宏观,后微观。对于一种电解质溶液,先观看,后分析;对于两种电解质混合的溶液,由于反应,则应先计算,后观看。具体解题思路是:算相关的物质的量,看...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
一.水解的前提 水解反应首先是将水分子一解为二,否则水解无从谈起。 H-OH被解离成H...
两瓶体积相同的溶液,一瓶醋酸,一瓶盐酸,pH同为2.5,即[H + ]同为约0.003mol/L。盐...
1.弱电解质电离平衡移动的3个易失分点 (1)误认为电离平衡正向移动,弱电解质的电离程...
电离平衡是中学化学教学中的重点和难点,是平衡知识的进一步深化,是对弱电解质的深刻...
...
...
...