
|
学习小专题 |

|
学习小专题 |
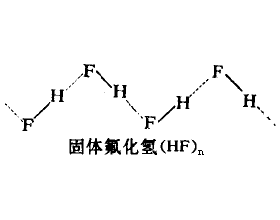 [探讨与扩展a] 氢键详细介绍 作者:黄瑞 来源:未知 日期:2016-01-24 19:56:37 点击:74458 所属专题:氢键02
[探讨与扩展a] 氢键详细介绍 作者:黄瑞 来源:未知 日期:2016-01-24 19:56:37 点击:74458 所属专题:氢键02
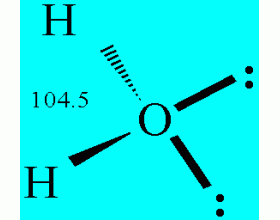
在基础有机化学中,曾经利用氢键解释醇和其它一些化台物的沸点及其在水中的溶解度等获得了很大成功。然而氢键的存在并不仅仅表现在这两方面,而且也不只局限在醇和酚等几类化合物中。事实上,氢键既存在于液体中,也存在于气体、晶体、溶液等各种状态中,且支配着化合物...
 [探讨与扩展a] 等电子体原理 作者:陈博殷 来源:未知 日期:2012-12-03 11:13:55 点击:5096 所属专题:等电子体
[探讨与扩展a] 等电子体原理 作者:陈博殷 来源:未知 日期:2012-12-03 11:13:55 点击:5096 所属专题:等电子体
具有VSEPR理论的相同通式AXmEn(A表示中心原子,X表示配位原子,下标n表示配位原子的个数,E表示中心原子的孤对电子对,下标m表示电子对数),又具有相同的价电子数的分子或离子具有相同的结构,这个原理称为等电子体原理...
 [探讨与扩展a] AlCl3为什么是共价化合物? 作者:陈万 来源:未知 日期:2012-12-03 11:15:49 点击:13379 所属专题:共价化合物 氯化铝
[探讨与扩展a] AlCl3为什么是共价化合物? 作者:陈万 来源:未知 日期:2012-12-03 11:15:49 点击:13379 所属专题:共价化合物 氯化铝
AlCl3是共价化合物,在气态时是双聚分子,化学式为Al2Cl6,氯化铝其中一个氯和和另一个氯化铝中的铝形成配位键,如图所示,每个铝周围都达到8个电子 : 这是因为离子键是正负电荷的吸引,共价键是电子云的重叠。三价铝离子半径过小,电荷过高,产生的电场强,即极化能力...
 [探讨与扩展a] 地壳元素丰度 作者:陈恒 来源:未知 日期:2011-12-12 09:41:10 点击:7562 所属专题:同位素 元素丰度
[探讨与扩展a] 地壳元素丰度 作者:陈恒 来源:未知 日期:2011-12-12 09:41:10 点击:7562 所属专题:同位素 元素丰度
确定地壳元素丰度,即元素的克拉克值,是地球化学的一项基础任务,一直受到各国地球化学家的重视。一些著名的地球化学家都在这方面有所贡献。通过对问题的不断深化和认识的提高,目前已比较可靠地获得了元素克拉克值的资料。 1889年,美国科学家克拉克等总结了世界各地5759...
 [注解与辨疑d] 3d轨道和4s轨道,哪个轨道能量大? 作者:王欣华 来源:未知 日期:2012-11-29 12:57:41 点击:15808 所属专题:能级09
[注解与辨疑d] 3d轨道和4s轨道,哪个轨道能量大? 作者:王欣华 来源:未知 日期:2012-11-29 12:57:41 点击:15808 所属专题:能级09
当3d轨道没有电子填充时,3d轨道的能量大于4s轨道能量(例如Na原子和 Ca原子);当3d轨道上已填充上电子时,4s轨道的能量大于3d轨道的能量(例如Ti原子和V原子)。因为3d轨道上填充有电子时,由于它对 4s电子产生屏蔽作用,使4s轨道电子能量升高的结果....
 [探讨与扩展a] 八隅体规则 作者:吴旭东 来源:未知 日期:2016-05-09 21:51:58 点击:17626 所属专题:8电子结构
[探讨与扩展a] 八隅体规则 作者:吴旭东 来源:未知 日期:2016-05-09 21:51:58 点击:17626 所属专题:8电子结构
二氧化碳中的化学键──中央原子(碳)被八个电子包围 八隅体规则(或称八电子规则)是化学中一个简单的规则,它指出各个原子趋向组合,令各电子的价层都拥有八个电子,与惰性气体拥有相同的电子排列。主族元素,如碳、氮、氧、卤素族、钠、镁都依从这个规则。简单而言,...
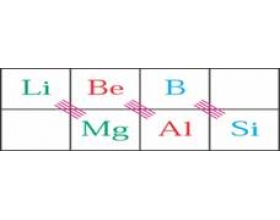 [探讨与扩展a] 化学上的对角线规则 作者:李开振 来源:未知 日期:2013-04-15 10:43:31 点击:28492 所属专题:对角线规则
[探讨与扩展a] 化学上的对角线规则 作者:李开振 来源:未知 日期:2013-04-15 10:43:31 点击:28492 所属专题:对角线规则
1.对角线规则 对比周期系中元素性质,发现: 左上~右下,对角线元素性质相似──对角线规则 周期系中如上三对元素对角关系明显。 对角线规则主要是从性质总结出来的经验规律,可从离子极化概念粗略解释。 2.对角元素性质的相似性 仅以B和Si这一对元素为例列举如下: 性质 B ...
 [探讨与扩展a] 金属半径、共价半径、范德华半径 作者:王绍红 来源:未知 日期:2012-12-03 10:27:54 点击:14934 所属专题:半径分类 半径数据
[探讨与扩展a] 金属半径、共价半径、范德华半径 作者:王绍红 来源:未知 日期:2012-12-03 10:27:54 点击:14934 所属专题:半径分类 半径数据
原子半径通常是指以实验方法测定的相邻两种原子核间距离的一半。从理论上说,核外电子无严格固定的运动轨道,所以原子的大小无严格的边界,无法精确测定一个单独原子的半径,因此目前所使用的原子半径数据只有相对的、近似的意义。根据测定的方法不同,有3种原子半径 (...
 [探讨与扩展a] 键长、键能、键角简介 作者:张超鹏 来源:未知 日期:2012-12-03 11:24:09 点击:12240 所属专题:键长 键能 键角
[探讨与扩展a] 键长、键能、键角简介 作者:张超鹏 来源:未知 日期:2012-12-03 11:24:09 点击:12240 所属专题:键长 键能 键角
键长: 成键原子核间的距离 杂化类型对键长的影响:对于CC键键长,有SP 3 SP 2 SP 共价键键长数据 (nm) 化合物 C-C C=C CC C-H CH 3 -CH 3 0.153 0.109 CH 2 =CH 2 0.134 0.109 C...
 [探讨与扩展a] 元素的电负性 作者:杨董 来源:未知 日期:2016-01-24 20:17:53 点击:19297 所属专题:电负性
[探讨与扩展a] 元素的电负性 作者:杨董 来源:未知 日期:2016-01-24 20:17:53 点击:19297 所属专题:电负性
元素的原子在分子中吸引电子的能力叫元素的电负性。元素的电负性愈大,表示该元素原子吸引电子的能力愈大,生成阴离子的倾向愈大。反之,吸引电子的能力愈小,生成阳离子的倾向愈大。表1列出了元素的电负性数值。元素的电负性是相对值,没有单位。通常规定氟的电负性为4...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【定义】又称离子有效半径,是通过实验测定的。一般认为的离子半径是:离子晶体中相邻...
关于117号元素是金属元素还是非金属元素的讨论以下几种意见: 1、非金属元素 虽然根据...
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是水素。氢是由英国化学家卡...
在我们身边的物质世界中,有气体,有液体,也有固体。他们都是由许许多多的肉眼看不见...
...
碳位于第二周期ⅣA,氮位于第二周期VA,根据同周期元素气态氢化物的稳定性从左到右依...
氯化铝(AlCl 3 )是铝的特征卤化物,它和AlBr 3 、AlI 3 均为共价化合物,而AlF 3 则是...
最新出炉的元素周期表中的第七周期中的化学元素已经被人类正式全部发现,雄心勃勃的各...