
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
三类反应连实验,活动顺序是条绳;比较异同找规律,突出重点记方程。
复习中的注意事项:
化学性质是重点,是物质间反应,是讲物质间的相互关系;同时某些物质的一种性质,还可能是另一种物质的制法。
![]()
![]() ① 氧化还原性
① 氧化还原性
② 酸碱性、两性——化合物
③ 金属性和非金属性——单质
④ 热稳定性——化合物
⑤ 可燃性——单质和化合物
⑥ 溶解性
学习方法:三抓三结合三方法。
三抓:抓规律:单质两性化三性, 共性及特殊性,
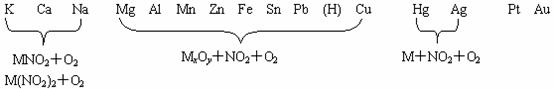
活动顺序表
抓关键:结构、性质、制法、用途、存在、鉴别,前二者是关键。
抓重点:金属 — Al、Fe;Na、Mg、Cu(K、Ca)
非金属 — S、N;O、Cl、C(H、P、Br、I、Si)
三结合:与化学理论结合,与化学实验结合,与化学计算结合。
三方法:在复习具体的化学性质时可采用以下方法。
叙述式:对某一物质的化学性质逐条写出,有完整的化学方程式。对第一阶段的复习或各族的代表物质及重要的物质应采取此种方法。
辐射式:以某一物质为中心,用箭头表示其有关的化学性质。进行简要的复习或一般物质可采取这种方式。
关系网式:用来表示相关物质的相互关系,是一种网络结构。
1.判断元素是金属元素还是非金属元素的判定规则:
(1) 所有非金属元素都包括在主族元素里;
(2) 在主族元素里,如果主族序数≥(周期数+1),则该元素为非金属元素,否则为金属元素(只有氢例外)。
2.地壳中元素的含量
|
元素 |
O |
Si |
Al |
Fe |
Ca |
Na |
K |
Mg |
H |
|
含量% |
48.60 |
26.30 |
7.73 |
4.75 |
3.45 |
2.74 |
2.47 |
2.00 |
0.76 |
3.火焰的颜色
白磷以黄色火焰燃烧成氧化物,能在O2、Cl2中自燃。
氨气不能在空气中燃烧,只能催化氧化;氨在纯氧中燃烧生成黄色火焰。
CO、CH4在空气中燃烧生成蓝色火焰,H2、S、H2S、酒精在空气中燃烧生成淡蓝色火焰,硫磺在纯氧中燃烧产生亮蓝色火焰。
乙烯燃烧时有明亮火焰,有黑烟生成;乙炔和苯燃烧时发出明亮而带浓烟的火焰。
焰色:
|
金属 |
钠 |
钾 |
锂 |
铷 |
钙 |
锶 |
钡 |
铜 |
|
焰色 |
黄色 |
紫色 |
紫红色 |
紫色 |
砖红色 |
洋红色 |
黄绿色 |
绿色 |
注:钾要透过蓝色钴玻璃观察。
4.气体的溶解性
(1) 极易溶于水的:NH3 700;HCl 500;其它卤化氢
(2) 易溶于水的:SO2 40;NO2
(3) 能溶于水的:H2S 2.6;Cl2 2.0;CO2 1;C2H2
(4) 难溶于水的:O2
5.既能与酸反应,又能与强碱溶液反应的物质
(1) 能生成两性化合物的金属:Al、Zn、(Be);
(2) 两性氧化物:Al2O3、ZnO、(BeO);
(3) 两性氢氧化物:Al(OH)3、Zn(OH)2、[Be(OH)2];
(4) 弱酸的铵盐:(NH4)2CO3、(NH4)2S、(NH4)2SO3、CH3COONH4 ;
(5) 酸式弱酸的钠、钾盐,可溶的其它金属盐:NaHCO3、KHSO3、Ca(H2PO4)2、NaHS、……;
(6) 氨基酸、多肽、蛋白质。
特殊:酯、油脂可在无机酸或碱溶液中加热水解。
既能与NaOH溶液反应,又能与浓硫酸或浓硫酸(氧化性)反应的有:H2S、HBr、HI、FeCl2。
既能与NaOH溶液反应,又能与氢氟酸反应的有:Si、SiO2 。
6.热稳定性的规律
一些挥发性酸及盐的热稳定性顺序为:相应氧化物>正盐>酸式盐>酸。如:SO2>Na2SO3>NaHSO3>H2SO3; SiO>Na2SiO3>H2SiO3; KNO3>HNO3
7.储气钢瓶的颜色
|
气体名称 |
储气瓶颜色 |
瓶体字样颜色 |
气体名称 |
储气瓶颜色 |
瓶体字样颜色 |
|
氧气 O2 |
蓝 色 |
黑 色 |
氦气 He |
褐 色 |
白 色 |
|
氮气 N2 |
黑 色 |
黄 色 |
氖气 Ne |
褐色(加红圈) |
白 色 |
|
压缩空气 |
黑 色 |
白 色 |
氩气 Ar |
灰 色 |
绿 色 |
|
液化石油气 |
银灰色 |
蓝 色 |
氪气 Kr |
白 色 |
黑 色 |
|
氯气 Cl2 |
绿 色 |
白 色 |
氙气 Xe |
白 色 |
黑 色 |
|
氨气 NH3 |
黄 色 |
黑 色 |
|
|
|
8.在许多反应中,水可以作催化剂。如在非常干燥的情况下,氯气和金属不能化合,氟化氢不能腐蚀玻璃,爆呜气在加热到1000时还不爆炸。平常这些反应都能迅速进行,这是微量水蒸气存在的缘故。又如滴水生烟:![]() DH= - Q。
DH= - Q。
9.氯气、浓硝酸使碘化钾淀粉试纸先变蓝,后褪色的原因是:
Cl2+2KI=2KCl+I2
5Cl2+I2+6H2O=2HIO3+10HCl
2KI+4HNO3(浓)=2KNO3+I2+2NO2↑+2H2O
I2+10HNO3=2HIO3+10NO↑+4H2O
10.从苦卤中提取KCl
用海水制1吨NaCl,可得苦卤0.
苦卤中除KCl外,还有NaCl、、MgCl2等。使苦卤水在提高温度下蒸发,NaCl和MgSO4能不断结晶析出。而KCl和MgCl2仍留在溶液中,当蒸发到溶液密度为1.
11.变色玻璃
本世纪六十年代,科学家创制了一种会变色玻璃,它随外界光线的强弱而改变颜色。当光线不足时它是无色的;光线较强时显浇黑色,光线很强时呈墨色。
在熔制普通光学玻璃时,加进适量的溴化银和少量的氧化铜,就可制得变色玻璃。其原因是:
2AgBr![]() 2Ag+Br2
2Ag+Br2
2Ag+Br2![]() 2AgBr
2AgBr
12.从浓厚卤中提取溴
溴水中溴以溴化物(KBr、NaBr、MgBr2等)形式存在,在13.

(1) 通Cl2,(2) 萃取(用CCl4),(3) CCl4沸点:76.
Br2+2NaOH=NaBr+NaBrO+H2O
所得NaBr、NaBrO与CCl4分离,然后加浓H2SO4,
NaBr+NaBrO+=Br2+Na2SO4+H2O
(4) 蒸镏分离,去杂。
13.氟气
许多金属都能在氟气中燃烧:Mg+F2=MgF2
硅跟氟气一接触,会立即发光燃烧。这个性质往往被用来鉴别氟气。Si+
能灭火的水竟会跟F2猛烈反应而发火燃烧。
在氟气中,几乎所有的有机物都会发火燃烧。CH4+
在稍高温度下,玻璃(Na2O·CaO·6SiO2)在氟气中也会化为乌有。SiO2+4HF=SiF4+2H2O
高温、高压或放电的情况下,稀有气体也能跟氟气化合,生成相应的氟化物,如XeF2、XeF4、XeF6、KrF2等。
铜、镍等金属跟作用以后形成一层不易挥发的保护膜,故可用Cu或Ni的容器贮存氟。
14.卤素化合物的溶解性
AgCl、Hg2Cl2、Cu2Cl2、PbCl2等难溶于水。
溴和碘的铜(Ⅰ)、银、汞(Ⅰ)和铅盐难溶于水,其它的溶于水。
AgF 溶于水,CaF2 不溶于水。
AgCl AgBr AgI
颜 色 白色 浅黄色 黄色
溶 解 性 不溶 不溶 不溶
加入过量的浓氨水 完全溶解 部分溶解(特大量时全溶) 不溶解
CuI2 金黄色, PbI2 橙黄色, FeI2·4HO 灰黑色
15.氮的氧化物
|
|
N2O |
NO |
N2O3 |
NO2 |
N2O4 |
N2O5 |
|
N的价态 |
+1 |
+2 |
+3 |
+4 |
+4 |
+5 |
|
熔点 / ℃ |
-102.4 |
-163.6 |
-102.2 |
-92 |
-11.1 |
30(分解) |
|
沸点 / ℃ |
-88.5 |
-151.8 |
3.5(分解) |
|
21.3(分解) |
47(分解) |
|
颜色、物态 |
无色气体 |
无色气体 |
熔点以下为蓝色固体 |
红棕色气体 |
无色气体 |
白色固体 |
|
|
|
|
亚硝酐 |
|
|
硝酐 |
在
16.黑色火药是KNO3 75%,S 10%,木炭 15%的混合物,曰:一硫二硝三木炭。
S+![]() K2S+3CO2+N2
K2S+3CO2+N2
制黑色火药时不能用硝酸钠,因硝酸钠有吸湿性。
17.王水:一体积浓硝酸和三体积的浓盐酸的混合物。
逆王水:三体积浓硝酸和一体积的浓盐酸的混合物。
红酸:一体积浓硝酸和一体积的浓盐酸的混合物。
纯硝酸:密度 1.
含氯化氢20.2%的盐酸沸点最高(
稀硝酸:1∶3,为4 mol / L。
稀硫酸:1∶5,为26.4 mol / L。
稀盐酸:1∶5,为7.1 mol / L。
浓硫酸 98%
浓盐酸 37%
浓硝酸 69.2%
除金、铂、铱、铑、钌、钛、铌、钽等金属外,硝酸几乎可氧化所有金属。Fe、Ae。Fe、Ar、Cr、Ni、Co等溶于稀硝酸,而不溶于冷浓硝酸。
硝酸与金属反应不是置换反应,不产生氢气。
硝酸是强氧化剂,把金属氧化为高价;硝酸本身被还原的产物同时有多种,还原产物以何种为主,这与金属的活泼性和硝酸的浓度有关。一般是:浓硝酸被还原为NO2,稀硝酸被还原为NO。若酸的浓度较稀时,则被还原为NH3,NH3与过量硝酸反应生成硝酸铵。
18.硝酸盐的热分解规律
例如:2KNO3![]() 2KNO2+O2↑
2KNO2+O2↑
2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1) 分解产物都有氧气,所以硝酸盐在高温下是强氧化剂。
(2) 金属越活泼,越不能以游离态存在。
(3) 凡不太活泼的金属硝酸盐分解都有NO2生成。
(4) 在硝酸盐分解的化学方程式中,硝酸盐的化学计量数皆为2。
但:5NH4NO3=2HNO3+4N2↑+9H2O
19.铵盐的热分解
铵盐受热时,一般放出氨气。但硫酸铵、磷酸铵稳定,硝酸铵分解情况复杂。
(NH4)2CO3![]() 2NH3+CO2+H2O↑
2NH3+CO2+H2O↑
NH4HCO3 ![]() NH3↑+H2O↑+CO2↑ (气儿肥)
NH3↑+H2O↑+CO2↑ (气儿肥)
NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
NH3+HCl = NH4Cl
2NH4I![]() 2NH3+H2+I2
2NH3+H2+I2
(NH4)3PO4![]() 3NH3+H3PO4
3NH3+H3PO4
NH4NO3![]() N2O+2H2O↑
N2O+2H2O↑
5NH4NO3=2HNO3+4N2↑+9H2O
2NH4NO3 ![]() 2N2+O2↑+4H2O (爆炸)
2N2+O2↑+4H2O (爆炸)
20.碳酸盐和碳酸氢盐的规律
(1) 热稳定性
① 碳酸盐>碳酸氢盐>H2CO3
② 同一主族元素(为碱金属元素)的碳酸盐
Li2CO3<Na2CO3<K2CO3<Rb2CO3
③ 碱金属的碳酸盐>碱土金属的碳酸盐>过渡元素的碳酸盐
(2) 加热分解规律
钾、钠的碳酸盐受热不分解。
碳酸盐![]() 金属氧化物+CO2
金属氧化物+CO2
碳酸氢盐![]() 正盐+H2O+CO2
正盐+H2O+CO2
H2CO3![]() H2O+CO2
H2O+CO2
(3) 溶解性
① 碳酸氢盐都溶于水,钾、钠、铵的碳酸盐溶于水。
② 可溶性碳酸盐对应的碳酸氢盐的溶解程度不大,难溶性碳酸盐对应的碳酸氢盐的溶解程度大。
(4) 碳酸盐和碳酸氢盐都能被酸分解,这可用于制取CO2和检验![]() 、
、![]() 。
。
(5) 碳酸盐和碳酸氢盐的互变规律
![]()
21.碳与氧化物发生氧化还原反应中,生成什么产物?(CO2或CO)
同时产生,但温度超过![]() 2CO,2CO2=2CO+O2 。
2CO,2CO2=2CO+O2 。
例如:C+2CuO![]() 2Cu+CO2↑
2Cu+CO2↑
![]() CO
CO
22.正盐+对应酸 ® 对应酸式盐
K2SO4十H2SO4=2KHSO4
CaCO3+H2O+CO2=Ca(HCO3)2
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
(NH4)2SO3+SO2十H2O=2NH4HSO4
23.玻璃
(1) 普通玻璃(钠玻璃):原料是纯碱、石灰石、石英,它是Na2CO3、CaCO3和(过量)SiO2熔化在一起所得到的物质。组成可表示为Na2O·CaO·6SiO2。
(2) 硼酸盐玻璃:原料中加入硼砂(Na2B4O7·10H2O),耐热仪器玻璃,膨胀系数小,能够耐骤冷、骤热,化学稳定性好,能耐酸、碱腐蚀,可用于制造化学仪器。
(3) 铅玻璃:原料中加入PbO2 。折光率强,用于制作光学仪器。
(4) 钢化玻璃:把普通玻璃放入电炉里加热,使它软化,然后急骤冷却,得到钢化玻璃。机械强度比普通玻璃大4倍~6倍,不易破碎。破碎时碎块无尖锐棱角,不易伤人,可制作汽车或火车的车窗。
(5) 石英玻璃:膨胀系数很小,相当于普通玻璃的1 / 18。能经受温度的剧变。耐酸性能好(除HF外),常用来制作耐高温的化学仪器。
(6) 有色玻璃:蓝玻璃(钴玻璃),原料中加Co2O3;红玻璃,原料中加Cu2O。
(7) 玻璃钢:环氧树脂跟玻璃纤维复合,就制得密度类似钢的增强塑料——玻璃钢。用玻璃纤维或玻璃布增强的塑料。
(8) 玻璃纤维:由熔融玻璃拉成或吹成的纤维,长的叫玻璃丝,短的叫玻璃棉。
(9) 水玻璃:Na2SiO3的水溶液,无色粘稠液体,是一种矿物胶,既不能燃烧也不受腐蚀。在建筑工业上可作粘合剂,耐酸水泥掺料等。木柴、织物浸过水玻璃后,具有防腐性能,且不易着火,作耐火材料。
(10) 玻璃纸:把纤维素信次用浓NaOH、CS2处理,再把生成物溶于稀NaOH溶液中即形成粘胶液。如果把粘胶液通过狭缝压入稀酸中,可制成透明的薄膜,俗称玻璃纸。
(11) 有机玻璃:由透明的有机高分子化合物形成。成分是聚甲基丙烯酸甲酯:
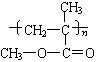
玻璃种类:普通玻璃、有色玻璃、钢化玻璃、硼酸盐玻璃、玻璃纤维、玻璃棉和玻璃布。
24.煤气
工业上所说的煤气有炉煤气、水煤气和半水煤气。
炉煤气是空气通过高温煤层,发生以下反应:
C+O2![]() CO2
CO2
![]() 2CO
2CO
2CO+O2![]() 2CO2
2CO2
C+CO2![]() 2CO
2CO
最后成分主要是1/3体积的CO和2/3体积的N2 。
水煤气是让水蒸气在高温下通过煤层产生。
C(灼热)+H2O(g)![]() CO2+H2
CO2+H2
副反应(在
CO+H2O![]() CO2+H2
CO2+H2
CO+3H2=CH4+H2O 2CO+2H2=CH4+CO2
为维持反应时所需要的高温,还发生如下反应:C+O2![]() CO2 (放热)
CO2 (放热)
水煤气的大致成分为:H2 47.7%,CO 42.3%,CO2 4.7%,N2 4%,O2 0.5%,CH4 0.6%。
半水煤气:将空气和水蒸气交替或混合后通过高温灼热煤层,得到相当于两体积的水煤气和一体积的煤气的混合气体。其成分按体积计大致为:H2 36.6%,N2 2175%,CO 34.3%,CO2 6.6%,CH4 0.5%,水 0.25%。
高炉煤气:从高炉顶放出的CO、CO2和N2等混合气体。其中含有大量灰尘和有害气体,必须净化处理,以防止污染环境。除去尘粒后的高炉煤气里含有热值很高的CO,可作气体燃料。
焦炉气:工为炼焦的气体产物,主要成分是H2和CH4,其中混有很少量的CO、CO2、C2H4、N2和其它气体,可作气体燃料。
25.金属的导电性和导热性大小
Ag Cu Au Al Zn Pt Fe Sn Hg
金属中,汞的熔点最低,-
钛的消耗量是人类消耗水平的标志。现在最重要的金属是铁,未来最重要的金属是钛。
26.铝的卤化物
AX3中,只有AlF3是离子化合物,无水AlCl3、AlBr3、AlI3都是共价化合物,它们是双聚分子。
AlCl3溶于非极性溶剂(如苯)或处于熔融状态时,都以共价的Al2Cl6二聚分子形式存在。但当它溶于水时,由于水合热很大,二聚分子即转变为[Al(H2O)6]3-和Cl-。
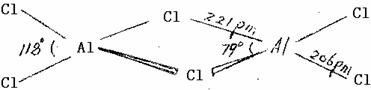
AlCl3在453K(
工业上用下法制取AlCl3:
在密闭容器内,通Cl2于熔融的金属铝中,2Al+3Cl2![]() 2AlCl3;由于放出大量热,故反应一开始就不需要热源。
2AlCl3;由于放出大量热,故反应一开始就不需要热源。
方法:1073K~1173K(
Al2O3+
从AlCl3的水溶液中只能得到AlCl3·6H2O。AlCl3溶液蒸干主要得Al2O3。Al2(SO4)3溶液蒸干主要得Al2(SO4)3 。
27.中学中遇到的催化剂:
MnO2、Fe、V2O5、Ni、Pt(Pt—Ru)、Ag、Cu、H2SO4、H3PO4、HgSO4、MnAc2、稀酸、稀碱、Al2O3(或AlCl3)、PbCl2、CuCl2、羧酸钴盐及各种生物酶。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...