
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
守恒思想是一种重要的化学思想,其实质就是抓住物质变化中的某一个特定恒量进行分析,不探究某些细枝末节,不考虑途径变化,只考虑反应体系中某些组分相互作用前后某种物理量或化学量的始态和终态。利用守恒思想解题可以达到化繁为简,化难为易,加快解题速度,提高解题能力,其具体表现形式如下:
一、 质量守恒
指物质变化前后,质量总和不变,它适用于所有反应。
例1. 用9g 草酸跟某二元醇完全酯化,生成环状酯mg和3.6g水,则该醇的分子量可以表示为( )
A、5m-27 B、10m-54 C、m-5.4 D、m+5.4
解析:草酸与二元醇完全酯化时,它们的物质的量是相等的。设反应中二元醇的质量为xg,则根据质量守恒定律有
9+x=m+3.6 x=m-5.4
9 g草酸相当于![]() 所以该醇的摩尔质量=
所以该醇的摩尔质量=![]() 即分子量为10m-54
即分子量为10m-54
答案:B
二、 元素守恒
指物质变化前后组成物质的元素种类不变,原子(或离子、原子团)的物质的量不变。这常用于有多步反应。解题思路是将其看成一个体系,整体思维着重分析过程的始态和终态,省略反应的中间过程,从而找出守恒关系。
例2.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100ml硫酸溶液,充分反应后向滤液中加入10mol·L-1NaOH溶液,产生沉淀的质量与加入NaOH溶液体积的关系如附图所示。则所用硫酸溶
液的物质的量浓度为( )
A、3.50 mol·L-1
B、1.75 mol·L-1
C、0.85 mol·L-1
D、无法计算
解析:由图象可知,在B点时,溶液中的溶质只有Na2SO4,根据Na+和SO42-守恒可知:
![]()
![]() H2SO4 Na2SO4(SO42-守恒) 2NaOH(Na+守恒)
H2SO4 Na2SO4(SO42-守恒) 2NaOH(Na+守恒)
![]()
C(H2SO4)=![]()
答案:B
三、 电子守恒
常用于氧化还原反应中及原电池、电解池的两极反应等,其原理是氧化剂得到的电子总数等于还原剂失去的电子总数。
例3. 3.48 g Fe3O4完全溶于100mLH2SO4中,然后加入K2Cr2O7溶液25mL,恰好使Fe2+全部被氧化为Fe3+,Cr2O72-全部转化为Cr3+, 则K2Cr2O7溶液的物质的量浓度为( )
A、0.05mol·L-1 B、0.1 mol·L-1
C、0.2 mol·L-1 D、0.3 mol·L-1
解析:n(Fe3O4)=![]()
![]() ,所以Fe2+为0.015mol
,所以Fe2+为0.015mol
![]()
![]() 参加反应失去e-为0.015mol
参加反应失去e-为0.015mol
![]()
氧化剂得电子总数为0.025×C(K2Cr2O7) ×6
根据电子守恒原理得:
0.025× C(K2Cr2O7) ×6=0.015
C(K2Cr2O7)=0.1mol·L-1
答案:B
例4.用两只惰性电极插入500mlAgNO3溶液中,通电电解,当电解液的PH值从6.0变为3.0时(设电解时阴极没有氢气放出,且电解液在电解前后体积变化可以忽略)电极上应析出银的质量是________。
解析:电解时,阴阳两极通过的电子守恒,即
![]() =
=![]()
![]()
答案:0.054g
四、 电荷守恒
常用于电解质溶液中,其原理是电解质溶液中,所有阳离子所带电荷总数等于所有阴离子所带电荷总数。
例5.物质的量浓度为0.1mol/L 的氨水和氯化铵混合液,已知NH3·H20的电离能力比NH+的水解能力强,对该溶液下述关系正确是( )
A、[OH-]>[H+] B、[H+]+[NH4+]=[OH-]+[Cl-]
C、[NH3·H2O]<[OH-] D、[NH4+]<[NH3·H2O]
解析:根据电荷守恒得:[H+]+[NH4+]=[OH-]+[Cl-]
![]() 又因为 NH3·H20 NH4+ + OH- 趋势大于
又因为 NH3·H20 NH4+ + OH- 趋势大于
![]() NH4+ +H2O NH3·H2+H+ 故[OH-]>[H+]
NH4+ +H2O NH3·H2+H+ 故[OH-]>[H+]
[NH4+]>[NH3·H20]
答案:A、B
指物质变化过程中,能量在转化和传递过程中,能量的总数量不变,也就是说,化学反应的反应热只与反应的始态和终态有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同,即盖斯定律。使用该定律应注意:总反应与分步反应条件应相同,且热化学方程式可以相加减。
例6:已知:
C(S)+O2(g)=CO2(g) △H=-393.5kJ/mol
CO(g)+![]() O2(g)= CO2(g) △H =-283.oKJ/mol
O2(g)= CO2(g) △H =-283.oKJ/mol
计算:C(S)+ ![]() O2 (g)= CO (g)的△H
O2 (g)= CO (g)的△H
解析:构造途径
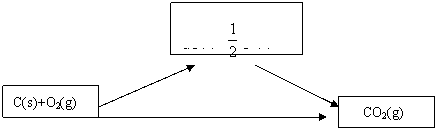
△H1 △H 2
△H 3
根据盖斯定律得:
△H 3=△H 1+△H 2
△H1=△H3 -△H2
C(S)+O2(g)=CO2(g) ……① △H3=-393.5KJ/mol
CO(g)+![]() O2=CO2(g)……② △H2=-283.0KJ/mol
O2=CO2(g)……② △H2=-283.0KJ/mol
①-②得:
C(s)+ ![]() O2(g)=CO(g)
O2(g)=CO(g)
△H1=△H3-△H2=-393.5KJ/mol-(-283.0KJ/mol)
=-110.5KJ/mol
总之,在化学计算中用守恒思想解题是一种重要的解题技巧,尤其在选择题中。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
化学是研究物质变化的科学 化学研究物质的组成、结构、性质、...
哲学是干什么的?据说一百个哲学家有一百种回答。中学阶段对...
中学化学课本中有大量的数据材料用来说明物质的性质及其变化...
前言:高中的几年是学生生涯中很重要的阶段,但也正因它有三...
对于基础不好的同学来说,最痛苦的事情就是,听课好不容易听...
一、化学学科的特点 化学是建立在实验基础上的、对物质的结构...