
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在涉及金属铝及其化合物的计算中,有一类重要的计算,就是铝盐溶液与强碱溶液、偏铝酸盐与强酸溶液的反应计算,这类计算有其特殊的计算关系和相应的图象。
1.铝盐溶液与强碱溶液(或Na、Na2O、Na2O2)反应
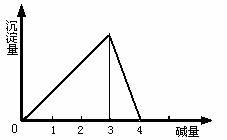
(1) 当0<![]() ≤3时,产生Al(OH)3沉淀。
≤3时,产生Al(OH)3沉淀。
发生反应的离子方程式为:Al3++3OH-=Al(OH)3
溶液中有Al3+,无![]() ,还有Al(OH)3。
,还有Al(OH)3。
n[Al(OH)3]=![]() n(OH-)
n(OH-)
当![]() =3时,生成的Al(OH)3沉淀最多。(注:这里不考虑溶液中能溶解极少量的氢氧化铝)
=3时,生成的Al(OH)3沉淀最多。(注:这里不考虑溶液中能溶解极少量的氢氧化铝)
(2) 3<![]() <4时,生成的Al(OH)3沉淀部分溶解。
<4时,生成的Al(OH)3沉淀部分溶解。
发生反应的离子方程式为:Al(OH)3+OH-=![]() +2H2O
+2H2O
溶液中有![]() ,无Al3+,还有Al(OH)3¯。
,无Al3+,还有Al(OH)3¯。
n [Al(OH)3] = 4n (Al3+)-n (OH-)
(3) 当![]() ≥4时,生成的Al(OH)3沉淀全部溶解。
≥4时,生成的Al(OH)3沉淀全部溶解。
Al3++3OH- = Al(OH)3¯
Al(OH)3+OH- =![]() +2H2O
+2H2O
Al3++4OH- = ![]() +2H2O
+2H2O
溶液中只有![]() ,无Al3+,无Al(OH)3¯。
,无Al3+,无Al(OH)3¯。
有关的反应图象与滴加溶液顺序有关:
在一定量的铝盐溶液中,逐滴加入强碱溶液,相关的图象如下:
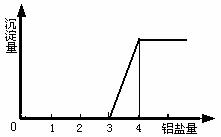
在一定量的强碱溶液中逐滴加入铝盐溶液,相关的图象如下:
2.偏铝酸盐溶液与强酸溶液反应
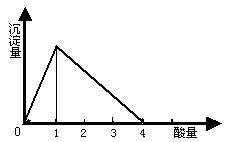
(1) 当0<![]() ≤1时,产生Al(OH)3沉淀。
≤1时,产生Al(OH)3沉淀。
发生反应的离子方程式为:![]() +H++H2O=Al(OH)3¯
+H++H2O=Al(OH)3¯
溶液中有![]() ,无Al3+,还有Al(OH)3¯。
,无Al3+,还有Al(OH)3¯。
n[Al(OH)3]=n(H+)
当![]() =1时,生成的Al(OH)3沉淀最多。(注:这里不考虑溶液中能溶解极少量的氢氧化铝)
=1时,生成的Al(OH)3沉淀最多。(注:这里不考虑溶液中能溶解极少量的氢氧化铝)
(2) 1<![]() <4时,生成的Al(OH)3沉淀部分溶解。
<4时,生成的Al(OH)3沉淀部分溶解。
发生反应的离子方程式为:Al(OH)3+H+=3Al3++3H2O
溶液中有Al3+,无![]() ,还有Al(OH)3¯。
,还有Al(OH)3¯。
n[Al(OH)3]=![]() [4n (
[4n (![]() )-n (H+)]
)-n (H+)]
(3) 当![]() ≥4时,生成的Al(OH)3沉淀全部溶解。
≥4时,生成的Al(OH)3沉淀全部溶解。
![]() +H++H2O = Al(OH)3¯
+H++H2O = Al(OH)3¯
Al(OH)3+3H+ = Al3++3H2O
![]() +4H+ = Al3++2H2O
+4H+ = Al3++2H2O
溶液中只有Al3+,无![]() ,无Al(OH)3¯。
,无Al(OH)3¯。
有关的反应图象与滴加溶液顺序有关:
在一定量的偏铝酸盐溶液中,逐滴加入强酸溶液,相关的图象如下:
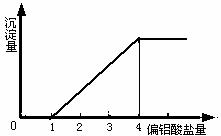
在一定量的酸溶液中,逐滴加入偏铝酸盐,相关的图象如下:
从接触的题目来看有两类,一类是文字叙述的计算,另一类是涉及相关图象的计算。
例1:在含a mol AlCl3的溶液中加入含b mol NaOH的溶液后有沉淀生成,再继续加入NaOH溶液直到2b mol NaOH时,沉淀与加b mol NaOH时一样多。试确定a与b的数量关系。
解析:加入b mol NaOH,使Al3+转化为Al(OH)3沉淀![]() mol,另有b mol NaOH,使Al3+转化为
mol,另有b mol NaOH,使Al3+转化为![]()
![]() mol,利用铝元素质量守恒可得:a=
mol,利用铝元素质量守恒可得:a=![]() mol+
mol+![]() mol=
mol=![]() mol。
mol。
另解:按公式计算可得下式:n[Al(OH)3]=4C(Al3+)V(Al3+)-C(OH-)V(OH-),![]() mol=(4a-2b) mol,a=
mol=(4a-2b) mol,a=![]() mol。
mol。
例2:将0.1 mol / L盐酸10 mL与0.5 mol / L AlCl3溶液50 mL混合,再加入2 mol / L NaOH溶液43 mL,能否得到沉淀?如能得到,此沉淀有多少克?
分析:NaOH首先将与HCl中和,若过量,会沉淀Al3+生成Al(OH)3沉淀;若再过量,则会使部分Al(OH)3沉淀溶解。因此要进行两次是否过量的判断。
解:n(HCl)=0.010 L×0.1 mol / L=0.001 mol, n(NaOH)=0.043 L×2 mol / L=0.086 mol,
NaOH与HCl反应,NaOH过量。反应后剩余NaOH为0.086 mol-0.001 mol=0.085 mol。
n(Al3+)=0.50 L×0.5 mol / L=0.025 mol,
![]() =3.4,此值小于4,大于3,故NaOH过量,将溶解部分生成的Al(OH)3沉淀。因此,能得到沉淀,其沉淀量为:(4×0.025 mol-0.085)×78 g / mol=1.17 g.。
=3.4,此值小于4,大于3,故NaOH过量,将溶解部分生成的Al(OH)3沉淀。因此,能得到沉淀,其沉淀量为:(4×0.025 mol-0.085)×78 g / mol=1.17 g.。
例3:向Al2(SO4)3和MgSO4的混合溶液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示。则原混合液中Al2(SO4)3与MgSO4的物质的量之比为 ( D )
A. 6∶1 B. 3∶1 C.2∶1 D.1∶2
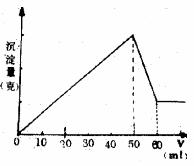
解析:如图所示,Al(OH)3沉淀消失需10 mL NaOH溶液,则生成Al(OH)3沉淀需30 mL NaOH溶液,故生成Mg(OH)2沉淀消失需20 mL NaOH溶液,
Al2(SO4)3 6NaOH MgSO4 2NaOH
![]()
![]()
![]()
![]()
![]() ∶
∶![]() =1∶2,故应选D。
=1∶2,故应选D。
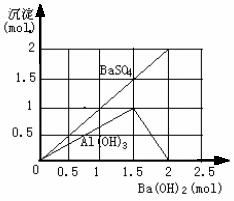
例4:向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至过量。
(1) 写出可能发生的有关反应的化学方程式;
(1) 在下图中,纵坐标表示生成沉淀的物质的量,横坐标表示加入Ba(OH)2溶液的物质的量。试在下图中画出当溶液中明矾为1 mol时,生成的每一种沉淀的物质的量随Ba(OH)2物质的量的变化曲线(在曲线上标明沉淀的化学式)。
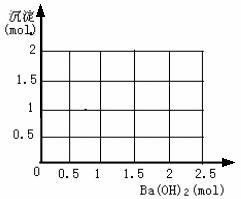
(2) 当向a L M mol / L的明矾溶液中滴加N mol/L的Ba(OH)2溶液b L,用含a、M、N的代数式表示:
① 当b满足___________________条件时,沉淀的总的物质的量为最大值;
② 当b满足___________________条件时,沉淀的质量为最大值。
答:(1) Ba2++![]() = BaSO4↓(2) Al3++3OH- = Al(OH)3↓ Al(OH)3+OH- =
= BaSO4↓(2) Al3++3OH- = Al(OH)3↓ Al(OH)3+OH- = ![]() +2H2O (2) 如图 (3) ①b =
+2H2O (2) 如图 (3) ①b = ![]() ②b =
②b = ![]()
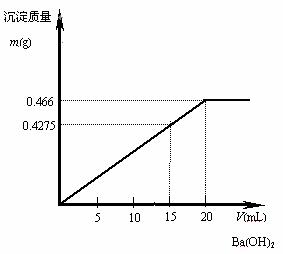
例5:在10 mL 0.1 mol / L的明矾溶液中逐滴滴入0.1 mol / L的Ba(OH)2溶液至过量,问生成的沉淀最大量是多少g?试在直角坐标系中绘出沉淀质量与Ba(OH)2溶液间关系的图象。
解析:在KAl(SO4)2溶液中滴入Ba(OH)2溶液,先发生的反应是:Ba2++![]() =BaSO4↓;Al3++3OH-=Al(OH)3↓;
=BaSO4↓;Al3++3OH-=Al(OH)3↓;
Al(OH)3的沉淀量达到最大值时,即![]() =
=![]() 时,滴入的Ba(OH)2溶液为
时,滴入的Ba(OH)2溶液为![]() ×0.01 mL×0.1 mol / L=1.5×10-3 mol,即15 mL。此时,
×0.01 mL×0.1 mol / L=1.5×10-3 mol,即15 mL。此时,![]() 未被全部沉淀,生成的沉淀总质量为:1.0×10-3 mol×78 g / mol+1.5×10-3 mol×233 g / mol=0.4275 g。
未被全部沉淀,生成的沉淀总质量为:1.0×10-3 mol×78 g / mol+1.5×10-3 mol×233 g / mol=0.4275 g。
当继续滴入Ba(OH)2溶液时,发生反应:Al(OH)3+OH-=![]() +2H2O和Ba2++
+2H2O和Ba2++![]() =BaSO4↓;当
=BaSO4↓;当![]() 被全部沉淀时,滴入的Ba(OH)2溶液为2×10-3 mol,即20 mL。这时滴入的OH-与原溶液中Al3+的物质的量之比恰好等于
被全部沉淀时,滴入的Ba(OH)2溶液为2×10-3 mol,即20 mL。这时滴入的OH-与原溶液中Al3+的物质的量之比恰好等于![]() ,Al3+全部转变为
,Al3+全部转变为![]() ,所得沉淀只有BaSO4,其质量为:0.02 mL×0.1 mol / L×233 g / mol=0.466 g。所以,生成的沉淀的最大量是0.466 g。
,所得沉淀只有BaSO4,其质量为:0.02 mL×0.1 mol / L×233 g / mol=0.466 g。所以,生成的沉淀的最大量是0.466 g。
以下问题可供练习:
1.有200 mL氯化镁、氯化铝的混合溶液,其中[Mg2+]为0.2 mol / L,[Cl-]为1.3 mol / L,要使镁离子转化为沉淀分离出来,至少需要加4 mol / L的氢氧化钠溶液的体积是 ( C )
A. 40 mL B. 72 mL C. 80 mL D. 128 mL
2.将含有0.1 mol明矾[KAl(SO4)2·12H2O]的溶液和100 mL 2 mol/L的Ba(OH)2溶液混合后,下列叙述正确的是 ( C )
A. 反应完毕后,液体仍然澄清
B. 液体浑浊,沉淀物是BaSO4
C. 生成0.1 mol Al(OH)3和0.2 mol BaSO4
D. 液体浑浊,沉淀物是Al(OH)3
3.将等体积的氯化铝溶液和氢氧化钾溶液混合, 所得沉淀物中含铝元素的物质的量与反应之后混合溶液中含铝元素的物质的量相等。则原氯化铝、氢氧化钾两种溶液的物质的量浓度之比可能是 ( BD )
A. 1∶3 B. 2∶3 C. 1∶4 D. 2∶7
4.向10 mL 0.2 mol / L的AlCl3溶液中逐滴加入未知浓度的Ba(OH)2溶液, 测得滴加15 mL与滴加45 mL所得沉淀同样多,则Ba(OH)2溶液的物质的量浓度是_________。
4. 0.08 mol / L
5.在0.1 L含有Fe3+、Al3+的溶液中加入金属钠,产生H2的质量与生成沉淀的质量关系如图所示:
(1) 在该溶液中[Al3+]= ;[Fe3+]= ;
(2) W2-W1的值为 ;W1的值为 。
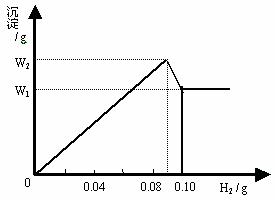
5. (1) 0.1 mol·L-;0.2 mol·L-;(2) 0.78 g;2.14 g

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
化学计算是化学学习中的重点,也是难点。中学化学常见的计算...
Fe 3+ 有较强的氧化性,可以把铁粉氧化成 Fe 2+ : 2Fe 3+ +Fe=3Fe 2...
在涉及金属铝及其化合物的计算中,有一类重要的计算,就是铝...
1、何为过量? 如某反应中两种反应物的量都已给出,则应先通过...
铁与稀硝酸的反应与反应物的量有关,原因在于金属铁有变价。...
一、问题的提出 将amolFe 3+ 、bmolCu 2+ 、cmolFe和dmolCu混合于同一反...