
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
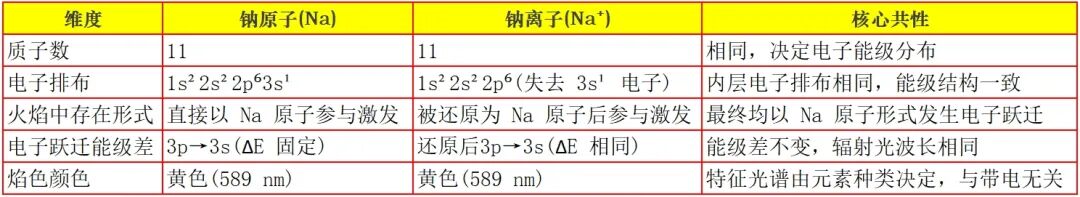
【导读】在火焰中Na⁺本身不发光,Na⁺会被还原或重新捕获电子,变成中性Na原子,随后被激发的Na原子在3p→3s能级间跃迁时释放出波长≈589nm左右的黄光(D线),所以Na与Na⁺在焰色试验中呈现相同的黄色。
一.焰色试验的原理是什么?
焰色试验的颜色来源于热激发后原子或离子的电子在返回基态时放出的光子。
当样品被火焰加热时,金属离子或原子中的电子吸收能量,跃迁到更高能级(激发态)。激发态不稳定,电子很快回落到较低能级,释放的能量以光的形式发射出来。
光的颜色(波长)取决于能级差:ΔE=hν=hc/λ,h为普朗克常数,c为光速,λ为波长。不同元素的原子、离子能级结构不同,发出的光色也不同。
二.Na原子与Na⁺离子核外电子结构差异是什么?

Na原子的价电子在3s轨道上,受热后容易被激发到3p(或更高)轨道随后在3p→3s的跃迁中放出约589nm的黄光(Na-D线)。
Na⁺离子已失去3s电子,其电子结构与惰性气体Ne相同,能级差远大于可见光范围,直接激发Na⁺会产生远紫外光,肉眼不可见。
三.为什么Na⁺在焰色试验中仍出现黄色?关键在于火焰的化学环境。
还原性气氛:本生灯火焰内部含有大量的·H、·OH、·C等自由基和电子,这些“还原剂”能够使Na⁺重新捕获一个电子,还原生成Na原子。
![]()
气化与激发:金属盐(如NaCl)在火焰中先被气化,分解为Na⁺与Cl⁻;而后Na⁺被还原为Na原子,火焰中自由电子充足,这个还原反应几乎瞬间完成,原子化效率很高,随即被火焰的热能激发至3p态。
发射黄色光:激发态的Na原子在返回3s基态时放出589nm(黄色)光子,形成我们观察到的明亮黄焰。因此无论是金属钠单质还是钠盐中的Na⁺,最终在火焰中产生颜色的活性激发态粒子都是同一激发态的中性Na原子,所以颜色相同。
四.其他金属是否也会出现如此情况?
是的。多数金属离子在火焰中被气化→还原/原子化→激发→发射,因此焰色试验本质上是对中性金属原子的检测。
只有少数金属(如碱金属、碱土金属及部分过渡金属)的激发能级差落在可见光范围内,才会出现明显的颜色。
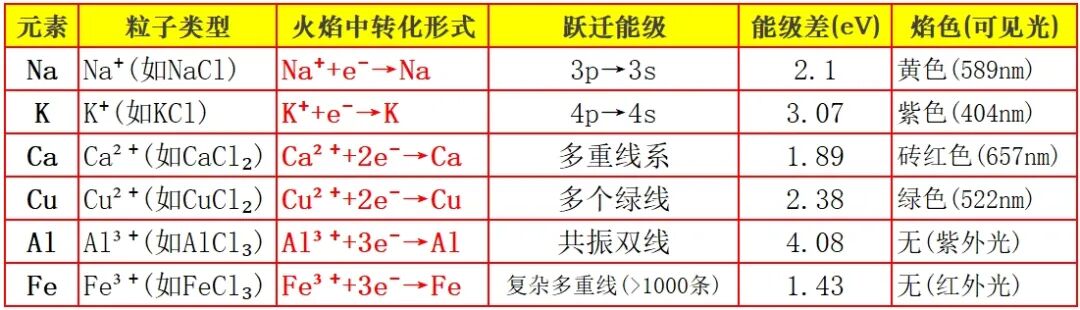
PS1:非金属元素“焰色试验”也会出现焰色吗?
如非金属元素如S、P的电子跃迁能级差多在紫外区,无明显焰色,焰色试验的研究对象主要是金属元素。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
关于“...
实验图示的常考变换 大π键又叫离域π键,何谓“离域”,顾名...
一、过氧化钠与水反应制取氧气的实验装置选择 过氧化钠是粉末...
实验图示的常考变换分析 1.正确操作流程: 2.实验图示: 02 示例...
首先切去一块绿豆大小的金属钠,擦干表面的煤油,除去氧化膜...
金属钠如何制备? 答: 1、戴维法: 戴维是通过电解法首先制得的金...