
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在分子或晶体中,相邻原子之间的强烈的相互作用叫做化学键。由于不同元素的原子结构各不相同,所以它们之间相互 作用的方式也不尽相同,这就形成了不同类型、不同强度的化 学键。化学键的基本类型有离子键、共价键(极性键、非极性键、 配位键)和金属键,这些化学键既有区别又有联系,在一定条件 下,相互过渡、相互转化.
一、离子键与共价键
1.离子键与共价楗的区别
①成键条件不同
在形成离子键时,典型金属和典型非金属原子发生电子得失,生成阳离子和阴离子,在明阳离子相互接近过程中,当离子间的静电吸引作用与电子云之间、两核之 间的排斥作用达到平衡,离子之间形成了离子键。共价键是靠 电子配对形成的,成键原子必须有未成对电子,成键时,原子还 必须沿电子云最大重叠方向相互靠近才能形成稳固的共价键。
②成键微粒不同
离子键是阴阳离子之间形成的化学键, 而共价键则是原子之间通过共同电子对形成的化学键。
③成键特征不同
离子键没有饱和性和方向性,一个带电 的离子只要空间条件允许可以从各个方向上吸引尽可能多的 带相反电荷的离子,不能认为+ 1价的阳离子只能吸引一个 -1价的阴离子,+2价的阳离子能够吸引两个-1价的阴离 子。亊实上,在离子晶体中,一个阳离子和几个阴离子成键只与 阴阳离子的半径比有关.共价键的特征是具有饱和性和方向 性,形成共价键的原子必须有未成对电子,原子的未成对电子 数有限,所以形成共价键的数目也是一定的。又因为P轨道在 空间上具有一定的伸展方向,形成共价键时,只有沿着电子云 最大重叠的方向相互靠近,才能形成牢固的共价键,所以共价 键又有方向性.在共价分子或原子晶体中的两个共价键之间也 就有了一定的键角。
④强度表示方法不同
离子键的强度一般用晶格能表示, 共价键的强度用键能表示,键能越大,分子越稳定.
2.离子鍵与共价键的过渡
离子键与共价键虽然有上述差别,伹是它们之间并没有严 格界限。我们知道,共价键又可以分为极性键和非极性键,在极 性键中,成鍵原子虽然没有发生电子得失,伹也因电子对的偏 移,使它们带有部分的正电荷或负电荷,键的极性越理,电负性 较小的原子对电子对的控制就越弱,当键的极性理到一定程度 时,电负性较小的原子将失去对电子对的控制,此时极性共价 键也就转化为离子键,因而极性键实际上是非极性共价键与离 子键之间的过渡状态,换句话说,离子键和非极性键是极性键 的两个极端。以下列物质为例:H - H、H - I、H -Br、H -Cl、 H - F、Na+ F-,从左到右键的极性增强,最终过度到离子键。在 化学上可用离子性百分数来定量描述离子键和共价键的过度状况,两种元素的电负性差越大,其化学键的离子性也越强。电负性差值与离子性百分数的关系见表1.
表1
电负性差 | 0 | 0.4 | 0.8 | 1.2 | 1.6 | 1.8 | 2.0 | 2.4 | 2.S | 3.2 |
离子性百 分数 | 0 | 4 | 15 | 30 | 49 | 55 | 63 | 76 | 86 | 92 |
由表1可知:
①Cs和F的电负性差为3.2,离子性百分效 为92%,也就是说,即使是最强的金属与最进的非金属化合时,化学键也不是纯粹的离子键,不妨做个比喻,在 CsF的离子键中,Cs失去的电子在8%的时间里要“回娘家“'。
②以氯气为例,两个成键原子的电负性差为零,离子性百分数为零,但即使在非极性键中电子对也不是“不偏不倚”的, 还会出现瞬间偶极,进一步产生范徳华力,使得这些共价分子 呈固态时形成分子晶体。
③由表中数据推知电负性差为1. 7时离子性百分数为 50% ,通常我们把电负值差大于1.7,离子性百分数在50%以 上的键称为离子键。反之,属于共价键。
④由于离子键与共价键是过渡的,使得离子化合物与共价化合物的界限也是模糊的。通常以熔点400℃为界,离子晶体在熔化时需要克服较强的离子键,熔点一般高于400℃;分子晶体在熔化时只需克服范德华力,故熔点一般低于400℃。这样, 金属氧化物、碱、盐一般属于离子化合物,而非金属氧化物、酸、 有机物等都属于共价化合物。
二、金属键与共价键
在金属晶体中,金属原子易失电子变成阳离子,失去的电 子成为“自由电子”,自由电子在原子和离子之间不停地交换, 这种作用把金属原子或离子结合在一起,形成金属键。在金属晶体中,金属原子是密堆的。例如:每个钠原子在晶体中与其他 8个钠原子相邻,每个钠原子失1个电子不可能按共价键那样共用电子,所以我们可以把金属键看做是少数自由电子存在于 多个原子之间离域程度很髙的共价键。
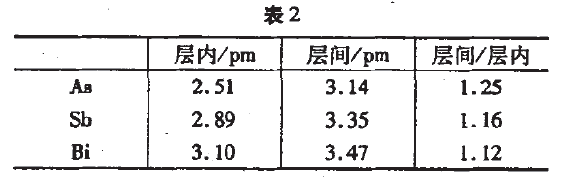
下面以氮族元素为例,分析共价健与金属键之间的过渡。氮有两种同素异形体:N2和N5,在固态时都是由共价分子通过 范徳华力构成的分子晶体。磷则有3种异形体:白磷是分子晶体,红磷是链状的,黑磷则具有层状结构,层内共价结合,层间电子是离域的,能够导电。从中可以看到共价键向金属键转化 的迹象与黑磷相似,灰珅、灰锑(砷和锑的同素异形体)和铋都 属于具有导电性的层状晶体,随着原子的电子层数增多,原子 半径增大,层内与层间的距离都增大,但层间距离与层内距离 的比值都依次减小,这说明上述晶体中,层的界限逐渐消失,原 子的结合趋向于密堆,即化学键从共价键向金属键过渡(见表 2)。由于锑和铋都处在周期表的对角线附近,所以最终也未能过渡到典型的密堆的金属晶体。
卤素单质都是双原子分子,两个原子共价结合,在固态时 形成分子晶体。随着原子半径增大,共价键键能减小,而随相对 分子质量增大,范德华力增大,造成分子间与分子内距离的比 值逐渐编小,说明分子间与分子内的界限趋向消失,原子的排 布趋向密堆,共价键向金属键过渡(见表3) I2晶体具有金属光 泽就是表现.
表3
分子内/pm | 分子间/pm | 分子间 / 分子内 | |
Cl2 | 1.99 | 2.97 | 1.50 |
Br2 | 2.27 | 3.33 | 1.45 |
I2 | 2.70 | 3.54 | 1.31 |
三、离子键和金属键
离子键存在于典型金属与典型非金属的化合物中,其本质 是阴、阳离子的静电作用,金属键存在于金属单质或合金中,是 金属阳离子与自由电子的静电作用。在本质上金属键与离子键 是相近的,二者的区别在于离子键只存在于化合物中,而金属 键则存在于金属单质或合金中。现以镁为例:镁单质和镁铝合金都是通过金属键结合的,由Mg2Si至Mg3P2、MgS、MgCl2按第 3周期从左到右随着电负性差逐渐增大,化学键的离子性百分 数增大,逐渐向离子键过渡。
总之,化学键的成因是原子结构的不稳定性,失电子的金 属性和得电子的非金属是逐渐过渡的,离子键、共价键、金属键 也不会是非此即彼,把过渡的思想渗透在中学化学教学中,可以促进学生树立辩证唯物主义世界观,提高科学素养。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
【定义】又称离子有效半径,是通过实验测定的。一般认为的离...
关于117号元素是金属元素还是非金属元素的讨论以下几种意见:...
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是...
在我们身边的物质世界中,有气体,有液体,也有固体。他们都...
...
碳位于第二周期ⅣA,氮位于第二周期VA,根据同周期元素气态氢...