
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电化学知识是高中学生学习的难点,高考理科综合的热点。电化学与物理中的电学知识和化学中的氧化还原知识有密切的联系,而氧化还原知识本身就是学生高中化学学习的一个难点。所以,学生普遍感到电化学知识难学,特别是电极反应难写。学习原电池和电解池知识,必须掌握电化学的基本原理,然后通过识别和练习,达到融会贯通。下面,归纳学习原电池和电解池必须明确的基础知识。
1.必须明确判断电极极性
原电池中发生氧化反应的一极(一般是活泼金属)是负极,发生还原反应的一极(一般是较不活泼金属或导电体)是正极。原电池装置中无外加电源,电解装置中一定有外加电源(原电池也可以作电源)。电解时,发生氧化反应的一极是阳极,阳极与电源的正极相连,与金属的活泼性无关;发生还原反应的一极是阴极,阴极与电源的负极相连。
2.必须明确电子流动方向和电流方向
原电池中,电子流动方向是电子从负极板流出,经导线流向正极;电流方向是从正极经导线--阳极--电解质溶液放电--阴极--导线到负极;
电解池中电子流动方向是从电源负极流出,流向电解池的阴极,通过电解质溶液放电,电子又从阳极流回电源的正极。电流的方向与电子流动的方向相反。
3.必须明确溶液中离子移动方向
原电池中,离子移动方向是阳离子移向正极,阴离子移向负极;电解池中,离子移动方向是阳离子移向阴极,阴离子移向阳极。
4.必须明确物质的放电顺序
原电池中,在负极先放电的是还原性强的物质,在正极先放电的是氧化性强的物质(分子或离子)。原电池中物质或离子的放电顺序为:
负极:Mg>Al>Zn>Fe>Pb>Cu>Hg>Ag;
正极:PbO2>Ag+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>H+(H2O)>Al3+;
电解池中,在阳极先放电的是还原性强的物质,在阴极先放电的是氧化性强的物质。电解池中物质或离子的放电顺序为:
阳极:Mg>Al>Zn>Fe>Pb>Cu>Hg>Ag>S2—>I—>Br—>Cl—>OH—>含氧酸根离子>F—
阴极:PbO2>Ag+>Fe3+>Cu2+> H+>Pb2+>Fe2+>Zn2+>H+(H2O)>Al3+;
5.必须明确其能量转化形式
原电池和电解池电路中都有电流通过,原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置。
6.必须明确反应特点
原电池和电解池总反应都是氧化还原反应,且氧化反应和还原反应都分别在两极上发生。总反应等于两个半反应之和。物质的放电顺序基本一样,串联电路中各电极上电子得失都相等,正负极或阴阳极都是交替连接。
7.必须明确原电池和电解池的构成条件
构成原电池的条件是:①活泼性不同的两个电极;②电解质溶液;③形成闭合电路;④有自发进行的氧化还原反应。
构成电解池的条件是:①有外加直流电源;②电解质溶液;③两个电极;④形成闭合电路。
8.必须明确“放电”的两种含义
放电的一层含义是泛指物质在电极上得到或失去电子的过程。不管原电池、电解池,物质在两极得到或失去电子都叫放电。根据电解原理、原电池原理,氧化还原半反应与电极反应的关系,可以确定在两极上放电的物质。
另一层含义是“放电”与“充电”意义相反,常在可逆电池中出现。充电专指电解,按反应方程式中箭头所指的方向为电解的总反应方程式。“放电”与“充电”恰好相反,专指发生原电池反应。按反应方程式中箭头所指的方向为原电池的总反应方程式。
如2Ag+Zn(OH)2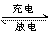 Ag2O +Zn+H2O
Ag2O +Zn+H2O
放电与充电不仅总反应方向相反,两电极上的半反应也恰好相反。原电池的正极反应是电解池的阳极反应的逆反应,原电池的负极反应是电解池的阴极反应的逆反应,且各自的半反应之和等于总反应。
9.必须明确电极是否参加反应
原电池中,负极材料若是还原性强的物质,则还原性强的物质失去电子发生氧化反应;若负极材料是惰性电极,则其它还原剂在负极上发生失去电子的氧化反应。正极材料若是氧化性强的物质,则该物质发生得电子的还原反应,正极材料若是惰性电极,则其它氧化剂在正极上发生得电子的氧化反应。
电解池中,阳极材料若是还原性强的物质(除金、铂外的活性金属电极),则阳极物质失去电子发生氧化反应;若阳极材料是惰性电极,则溶液中还原性强的阴离子在阳极上发生失去电子的氧化反应。阴极材料若是氧化性强的物质,则该物质发生得电子的还原反应,阴极材料若是惰性电极,则其它氧化剂(如溶液中氧化性强的阳离子)在阴极上发生得电子的氧化反应。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
【解析】: A.电解氧化的目的是在铝制品表面形成氧化膜,所以代...
并非所有放热反应都可以设计为原电池。能否设计为原电池的关...
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子...
一、天然冰晶石(NaAlF)的发现:18世纪的格陵兰矿物探索 天然...
【导读】“正/负”看电势,按照电势高低,高正低负,绝不互换...