
|
学习小专题 |
 化学汉字:如何区别氨、铵根、胺?
日期:2022-08-13 08:21:46
点击:1838
好评:0
化学汉字:如何区别氨、铵根、胺?
日期:2022-08-13 08:21:46
点击:1838
好评:0
氨:NH 3 ,电中性,氨是氮和氢的一种化合物,分子结构呈 三角锥形,其中氮原子有一对孤对电子.气态物质能独立存在, 具有刺鼻气味,很易溶于水,比空气轻. 铵: NH 4 + (离子)带一个单位正电荷,其中氮氢原子间形成 了一条配位键.但四个N—H键的键长、键能、键角完...
 新课程实验系列:铵盐的检验方法
日期:2021-10-19 16:53:49
点击:300
好评:0
新课程实验系列:铵盐的检验方法
日期:2021-10-19 16:53:49
点击:300
好评:0
...
 对镁与铵盐溶液反应的认识分析
日期:2016-02-02 21:54:47
点击:9718
好评:0
对镁与铵盐溶液反应的认识分析
日期:2016-02-02 21:54:47
点击:9718
好评:0
对于镁铝来讲,二者均是较活泼的金属,从其本身所具有的能力来讲(内因),完全有能力与水发生置换反应放出氢气(EAl 3+ /Al=-2.375V、EMg 2+ /Mg=-1.67V、EH 2 O/H 2 =-0.414V)。但事实上,在通常条件下,镁铝并不与水反应,其原因是因为当镁铝与水反应后,均会生成...
 铵盐分解的实质是什么?
日期:2016-01-21 16:10:07
点击:3844
好评:0
铵盐分解的实质是什么?
日期:2016-01-21 16:10:07
点击:3844
好评:0
铵盐分解的实质是铵离子给出质子(即H + )的过程。一般来讲对应的酸根离子结合质子的能力越强,则对应的铵盐越容易分解,例如卤化铵的热稳定性NH 4 F<NH 4 Cl<NH 4 Br<NH 4 I,铵盐的分解产物中不一定有氨气,如硝酸铵的分解等。铵盐检验时通常可以将铵盐溶解于水...
 铵盐分解规律
日期:2016-01-21 14:10:23
点击:6542
好评:0
铵盐分解规律
日期:2016-01-21 14:10:23
点击:6542
好评:0
铵盐热稳定性差,受热均能分解 . 但请注意:未必有 NH 3 产生 . 这由盐中对应酸的稳定性、挥发性、氧化性等因素来决定 . ① 稳定易挥发酸成的铵盐 NH 3 +酸的挥发性物质 如 NH 4 Cl (s) ==NH 3 + HCl ② 稳定难挥发酸成的铵盐 如 (NH 4 ) 2 SO 4 == 2NH 3 + H 2 SO 4...
 怎样认识铵盐受热分解的规律
日期:2016-01-19 22:25:00
点击:9174
好评:0
怎样认识铵盐受热分解的规律
日期:2016-01-19 22:25:00
点击:9174
好评:0
(1) 易挥性酸(不包括HNO 3 )的铵盐,受热分解生成合成它的物质:NH 3 和易挥发性酸(或NH 3 H 2 O和易挥发性气体).如: NH 4 HCO 3 NH 3 +H 2 O+CO 2 (NH 4 ) 2 CO 3 2NH 3 +H 2 O+CO 2 NH 4 Cl NH 3 +HCl 生成的混合物,若不加以分离,冷却后又会变为原来的反应...
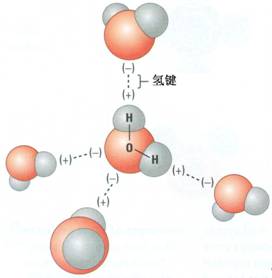 动画演示:氨分子及铵根离子结构
日期:2012-05-08 17:11:52
点击:759
好评:2
动画演示:氨分子及铵根离子结构
日期:2012-05-08 17:11:52
点击:759
好评:2
...
 课件学习:铵盐的性质
日期:2012-04-24 22:38:52
点击:262
好评:0
课件学习:铵盐的性质
日期:2012-04-24 22:38:52
点击:262
好评:0
...
 课件学习:铵盐和氨
日期:2012-04-24 22:04:53
点击:368
好评:0
课件学习:铵盐和氨
日期:2012-04-24 22:04:53
点击:368
好评:0
...
 动画演示:铵根离子的形成
日期:2012-04-24 21:59:00
点击:683
好评:0
动画演示:铵根离子的形成
日期:2012-04-24 21:59:00
点击:683
好评:0
...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。