
|
学习小专题 |
 如何理解反应热与焓变的单位?
日期:2021-09-13 14:41:38
点击:980
好评:0
如何理解反应热与焓变的单位?
日期:2021-09-13 14:41:38
点击:980
好评:0
在依据化学课程标准编写的中学化学教材中,通常都会有下列热化学方 程式: 2H 2 (g) + O 2 (g) =2H 2 O(1) Δ H =-571. 1 kJ mol -1 H 2 (g)++O 2 (g)= H 2 O(1) Δ H =-285. 8 kJ mol -1 在化学教学中,学生们常常会产生下列困惑:在热化学方程式中,Δ H 的单位...
 反应热与焓变是一回事吗?
日期:2018-08-05 15:20:24
点击:23202
好评:1
反应热与焓变是一回事吗?
日期:2018-08-05 15:20:24
点击:23202
好评:1
为什么不同教材中对焓变的描述不同呢,焓变与反应热之间的关系如何? 在热力学中,用Q表示反应过程中的热量变化。若反应吸热,则Q0; 若反应放热,则Q0。当体系处于变化过程时(反应物转变为生成物也是体系 的变化),体系与环境之间存在图1 - 8所示的能量交换。 当体系变化恢...
 微课视频:化学反应中的焓变
日期:2017-05-31 14:51:19
点击:406
好评:0
微课视频:化学反应中的焓变
日期:2017-05-31 14:51:19
点击:406
好评:0
微课视频:化学反应中的焓变。...
 解读焓变与反应热
日期:2016-05-17 19:32:49
点击:981
好评:0
解读焓变与反应热
日期:2016-05-17 19:32:49
点击:981
好评:0
第二页...
 如何理解焓变
日期:2016-01-31 21:03:38
点击:24183
好评:0
如何理解焓变
日期:2016-01-31 21:03:38
点击:24183
好评:0
焓 (enthalpy) ,符号 H ,是一个系统的热力学参数。 物理意义: ⑴ H=U+pV 焓 = 流动内能 + 推动功; ⑵ 焓表示流动工质所具有的能量中,取决于热力状态的那部分能量 定义一个系统内 : H = U + pV, 式子中 H 为焓, U 为系统内能, p 为其压强, V 则为体积。 对于在...
 如何理解热化学方程式中的“ΔH”?
日期:2016-01-31 20:38:40
点击:9980
好评:0
如何理解热化学方程式中的“ΔH”?
日期:2016-01-31 20:38:40
点击:9980
好评:0
《化学反应原理》中用H来表示反应热,常用单位为kJ mol -1 。在中学化学中单位与此类似的物理量有摩尔质量M和气体摩尔体积Vm。摩尔质量M的常用单位为 gmol -1 ,表示单位物质的量的物质所具有的质量;气体摩尔体积Vm的常用单位L mol -1 ,表示单位物质的量的气体所占的体...
 ΔH符号正负与放热吸热关系形象比喻
日期:2016-01-31 20:12:17
点击:18840
好评:0
ΔH符号正负与放热吸热关系形象比喻
日期:2016-01-31 20:12:17
点击:18840
好评:0
学生对于热化学中的吸热反应和放热反应中能量变化情况不是十分清楚,往往对于吸热反应 Δ H 大于 0 ,而放热反应 Δ H 小于 0 ,放热反应和吸热反应中反应物与生成物的能量大小关系等问题一知半解,容易弄混乱。为了让学生简单形象的弄清这些问题,我在教学中作了以下类...
 焓到底是什么?
日期:2014-09-04 16:41:34
点击:753
好评:0
焓到底是什么?
日期:2014-09-04 16:41:34
点击:753
好评:0
...
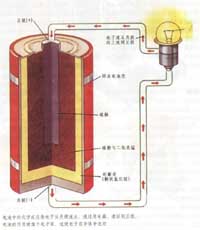 公开课短片-焓与反应热
日期:2013-05-03 11:02:35
点击:442
好评:0
公开课短片-焓与反应热
日期:2013-05-03 11:02:35
点击:442
好评:0
网易公开课视频-焓(第一集)与反应热(第二集)。来源于可汗学院,虽说是大学的基础化学内容,可做为高中阶段复习或扩展内容,很通俗易懂。...
 反应热与焓变辨析
日期:2013-03-25 15:07:49
点击:8160
好评:0
反应热与焓变辨析
日期:2013-03-25 15:07:49
点击:8160
好评:0
焓是与内能有关的物理量,反应在一定条件下是吸热还是放热由生成物和反应物的焓值差即焓变(△H)决定。 在化学反应过程中所释放或吸收的能量都可用热量(或换成相应的热量)来表示,叫反应热,又称“焓变”,符号用△H表示,单位一般采用kJ/mol 说明: 1、化学反应中不仅存...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。