
|
学习小专题 |
 为什么用最高价含氧酸判断非金属性的强弱?
日期:2025-08-27 15:05:49
点击:274
好评:0
为什么用最高价含氧酸判断非金属性的强弱?
日期:2025-08-27 15:05:49
点击:274
好评:0
元素周期律的应用,总会遇到金属性和非金属性强弱判断和比较。 苏教版《化学必修第一册》 P 11 7 : 元素单质和化合物的某些性质有助于判断元素的金属性,非金属性强弱。通常情况下,元素原子失电子能力越强,元素的金属性越强,它的单质越容易从水或酸中置换出氢,该元素最...
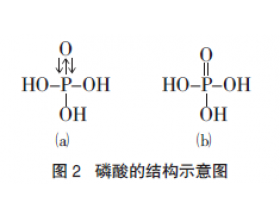 P元素的最高价氧化物对应水化物是H3PO4,为什么N元素却是HNO3?
日期:2020-11-17 17:37:20
点击:4248
好评:0
P元素的最高价氧化物对应水化物是H3PO4,为什么N元素却是HNO3?
日期:2020-11-17 17:37:20
点击:4248
好评:0
P 元素的最高价氧化物对应水化物可以是 H 3 PO 4 ,N 元素是 HNO 3 。为什么N不能 形成H 3 NO 4 ? 在 H 3 PO 4 中,P 原子采取 sp 3 杂化,三个杂化轨道与 O 原子形成三个σ 键,另一个杂化轨道被孤对电子占据,这个孤对电子进入O原子提供一个空 2p 轨道,形成配位键。同时...
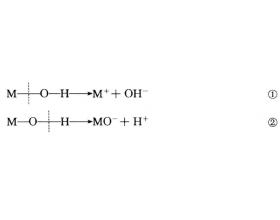 元素氧化物的水化物的酸碱性与其结构有什么关系?
日期:2019-11-11 16:22:02
点击:1233
好评:0
元素氧化物的水化物的酸碱性与其结构有什么关系?
日期:2019-11-11 16:22:02
点击:1233
好评:0
元素氧化物的水化物M(OH) x 在水溶液中有两种电离的可能性: 到底采取哪种电离方式,主要决定于分子内化学键的相对极性。 极性:M—OO—H,按①式离解,MOH显碱性;O一HM—O,按②式离解,MOH显酸性;如果M—O和O—H的极性相差不大,MOH为两性。 (1) M—O和O—H的极性相对强...
 最高价氧化物的水化物酸碱性强弱解释
日期:2016-03-22 10:35:49
点击:1853
好评:0
最高价氧化物的水化物酸碱性强弱解释
日期:2016-03-22 10:35:49
点击:1853
好评:0
...
 课件学习:主族元素最高价氧化物水化物
日期:2014-12-17 15:40:00
点击:451
好评:0
课件学习:主族元素最高价氧化物水化物
日期:2014-12-17 15:40:00
点击:451
好评:0
...
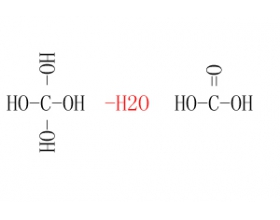 元素最高价氧化物对应水化物的写法
日期:2014-12-06 19:05:00
点击:63877
好评:37
元素最高价氧化物对应水化物的写法
日期:2014-12-06 19:05:00
点击:63877
好评:37
元素最高价氧化物对应的水化物,这一概念出现在高中化学必修2元素周期律那章,用于判断元素金属性和非金属性强弱。元素最高价氧化物对应水化物碱性越强,则金属性越强;元素最高价氧化物对应水化物酸性越强,则非金属性越强。 有些同学对于元素最高价氧化物对应的水化物...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。