
|
学习小专题 |
 无氧酸的酸性怎么比?
日期:2025-08-05 18:05:49
点击:463
好评:0
无氧酸的酸性怎么比?
日期:2025-08-05 18:05:49
点击:463
好评:0
无氧酸,又称氢酸,如 HCl、HBr、HI、HF、HS 等。无氧酸主要是元素周期表的第VA、VIA、VI a 族元素形成的氢化物。在水溶液中一般规律是,同主族,自上而下,酸性增强;同周期,自左而右,酸性增强。如下图所示: 影响无氧酸酸性的因素主要有啥? 无氧酸的酸性强弱主要取...
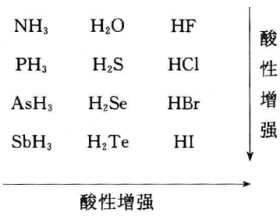 无氧酸的强度有何规律?如何解释?
日期:2019-11-15 08:46:29
点击:1541
好评:0
无氧酸的强度有何规律?如何解释?
日期:2019-11-15 08:46:29
点击:1541
好评:0
周期表上V A→VIA族元素的共价型氢化物在水或一些非水 溶剂中能够给出或结合质子而表现出酸碱性并有下述规律: 对此规律的解释大致有以下几种: (1)从H—A键的键能和键极性大小解释 上述氢化物在水溶液中释出H + 离子的难易程度与H—A之 间的键能以及这键的极性大小有关。...
 无机酸酸性强弱比较
日期:2019-11-13 15:00:32
点击:26150
好评:0
无机酸酸性强弱比较
日期:2019-11-13 15:00:32
点击:26150
好评:0
一、含氧酸酸性强弱变化规律 若用通式HxROy表示含氧酸,则其酸性强弱与R元素的非金属性及其原子的半径有关。R元素的非金属性越强,则其原子核对核外共用电子对的吸引力越强,R-O 间的共用电子对越偏向R原子的一方;R元素原子的半径越小,则R-O间的共用电子对也越偏向R原...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。