
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
侯氏制碱法
1、制备原理:
侯氏制碱法是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行(实质为勒夏特列原理).制备纯碱(Na2CO3),主要利用NaHCO3在溶液中溶解度较小,所以先制得NaHCO3,再利用碳酸氢钠不稳定性分解得到纯碱.要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用.
2、化学反应原理:
侯氏制碱法原理(又名联合制碱法)
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl=NaHCO3↓+NH4Cl (在反应中NaHCO3沉淀,所以这里有沉淀符号)
总反应方程式:
NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl
2NaHCO3 ==(加热)Na2CO3+H2O+CO2↑(CO2循环使用)
注意:NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓(溶解度一般,因为不断添加原料达到溶液饱和才沉淀)
(先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性,能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体.)
3、侯氏制碱法的优点:
保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%; NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成CO2,革除了CaCO3制CO2这一工序.
侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年创立的。不仅对我国的化学工业做出了巨大贡献,在世界上也享有盛誉。
值得注意的是:
”侯氏制碱法“中所制得的“碱”并不是我们熟知的“烧碱氢氧化钠NaOH”,而是纯碱“Na2CO3”。这里就需要另外一种工业上常见的“工业制烧碱法”进行区别了。
工业制碱法
工业制烧碱有苛化法和电解法
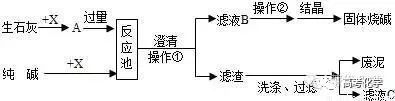
一、纯碱苛化法:
将纯碱、石灰分别经化碱制成纯碱溶液、石灰制成石灰乳,于99~101℃进行苛化反应,苛化液经澄清、蒸发浓缩至40%以上,制得液体烧碱.将浓缩液进一步熬浓固化,制得固体烧碱成品.苛化泥用水洗涤,洗水用于化碱.
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
二、电解法:
1、电解法简介:
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业.
2、电解饱和食盐水反应原理:
2NaCl+2H2O H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
因为NaCl是强电解质,在溶液里完全电离,水是弱电解质,也微弱电离,因此在溶液中存在Na+、H+、Cl-、OH-四种离子.当接通直流电源后,带负电的OH-和Cl-向阳极移动,带正电的Na+和H+向阴极移动.Cl-比OH-更易失去电子,在阳极被氧化成氯原子,氯原子结合成氯分子放出,使湿润的淀粉碘化钾溶液变蓝.H+比Na+容易得到电子,因而H+不断地从阴极获得电子被还原为氢原子,并结合成氢分子从阴极放出.在上述反应中,H+是由水的电离生成的,由于H+在阴极上不断得到电子而生成H2放出,破坏了附近的水的电离平衡,水分子继续电离出H+和OH-,H+又不断得到电子变成H2,结果在阴极区溶液里OH-的浓度相对地增大,使酚酞试液变红.

因此,阳极反应:2Cl--2e-=Cl2↑(氧化反应)
阴极反应:2H++2e-=H2↑(还原反应)
工业上利用这一反应原理,制取烧碱、氯气和氢气.
3、电解设备--离子交换膜电解槽.
(1)离子交换膜电解槽主要由阳极、阴极、离子交换膜、电解槽框和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成.电解槽的阳极用金属钛制成;阴极由碳钢网制成.
(2)阳离子交换膜的作用:①把电解槽隔为阴极室和阳极室;②只允许Na+通过,而Cl-、OH-和气体则不能通过.这样,既能防止生成的H2和Cl2相混合而发生爆炸,又能避免Cl2进入阴极区与NaOH溶液作用生成NaClO而影响烧碱的质量。
易错题解析
下列关于氨碱法(索氏)和联合制碱法(侯氏)说法错误的是( )
A.两者的原料来源相同
B.两者的生产原理相同
C.两者对食盐利用率不同
D.两者最终产品都是Na2CO3
【解答】
解:A.氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料,联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料,两者的原料来源不相同,故a错误;
B.氨碱法其化学反应原理是:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,联合制碱法:包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,故B正确;
C.氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,故C正确;
D.氨碱法(索氏)和联合制碱法(侯氏)两者最终产品都是Na2CO3,故D正确。
【答案】:A

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
进行判断的原则是:捉住本质,少定多变。以上述问题为例,无论哪一种物质过量,反应的...
通过结构分析,在水溶液中,碳酸氢根含有一个羟基-OH,那么相较于碳酸根,碳酸氢根离...
焰色反应是一个非常有意思的现象,这个实验也非常好做,我们在家里就可以实操(找一个...
图1.卡塔尔世界杯烟花(来源CCTV 5截图) 2022年11月20日,卡塔尔世界杯开幕式,五彩...
...