
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑6] 与金属有关的几个问题集 作者:李久明 来源:未知 日期:2016-01-19 09:55:23 点击:10808 所属专题:金属材料
[注解与辨疑6] 与金属有关的几个问题集 作者:李久明 来源:未知 日期:2016-01-19 09:55:23 点击:10808 所属专题:金属材料
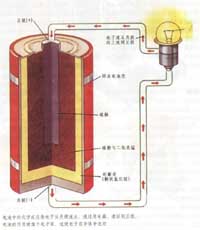
1. 金属在常温下都是固体吗? 大多数金属在常温下是固体(Hg在常温下是液体)。 2. 金属的颜色与什么有关? 对大多数金属而言,其中的自由电子能吸收所有频率的光,然后很快放出所有频率的光,因而大多数金属呈现钢灰色乃至银白色。也有少数金属,他们较易吸收某一频率...
 [注解与辨疑6] 四羟基合铝酸纳与偏铝酸钠是什么关系? 作者:郝军 来源:未知 日期:2021-11-25 11:34:58 点击:6822 所属专题:偏铝酸钠
[注解与辨疑6] 四羟基合铝酸纳与偏铝酸钠是什么关系? 作者:郝军 来源:未知 日期:2021-11-25 11:34:58 点击:6822 所属专题:偏铝酸钠
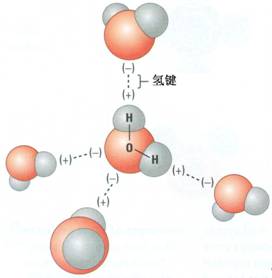
科学研究证明是四羟基合铝酸纳,属于配位化合物。 实际上,偏铝酸钠在水溶液中都是以Na[Al(OH) 4 ]和形式存在,以前只不过是为了方便,把它简写成NaAlO 2 。但它的实际组成还是Na[Al(OH) 4 ]。 NaAlO 2 偏铝酸钠是简写,就像氢离子(H + )实际上是水合氢离子一样。这个就...
 [注解与辨疑6] 生成氢氧化铝沉淀的途径小结 作者:曹启凤 来源:未知 日期:2012-05-23 10:24:38 点击:5045 所属专题:氢氧化铝
[注解与辨疑6] 生成氢氧化铝沉淀的途径小结 作者:曹启凤 来源:未知 日期:2012-05-23 10:24:38 点击:5045 所属专题:氢氧化铝
(1)铝盐和适量强碱溶液反应 AlCl 3 +3NaOH(适量)=Al(OH) 3 ↓+3NaCl (2)铝盐和氨水反应 AlCl 3 +3NH 3 ·H 2 O=Al(OH) 3 ↓+3NH4Cl (3)偏铝酸盐和适量强酸反应 NaAlO 2 +HCl(适量)+H 2 O = Al(OH) 3 ↓+NaCl (4)偏铝酸盐和弱酸反应 2NaAlO 2 +CO 2 +3H 2 O=2Al(OH) 3...
 [注解与辨疑6] 氢氧化铝的电离方程式有什么应用 作者:爱莉 来源:未知 日期:2017-05-03 16:46:26 点击:15958 所属专题:氢氧化铝 电离方程式
[注解与辨疑6] 氢氧化铝的电离方程式有什么应用 作者:爱莉 来源:未知 日期:2017-05-03 16:46:26 点击:15958 所属专题:氢氧化铝 电离方程式
氢氧化铝是一种两性氢氧化物。它在水溶液中存在两种形式的电离。其电离方程式可表示如下: 应用氢氧化铝的上述电离方程式,不但可以解释氢氧化铝具有两性的原因,而且还可以熟悉氢氧化铝的制法、了解“双水解”的概念和判断溶液中某些离子能否共存的问题等。 (1)由Al 3+...
 [注解与辨疑6] FeCl3溶液与金属的反应 作者:范瑞开 来源:未知 日期:2021-03-26 10:03:32 点击:5263 所属专题:氯化铁
[注解与辨疑6] FeCl3溶液与金属的反应 作者:范瑞开 来源:未知 日期:2021-03-26 10:03:32 点击:5263 所属专题:氯化铁
(1)FeCl 3 溶液与活动性不太强的金属如Cu的反应,由于Fe 3+ 有较强的氧化性,将Cu氧化成Cu 2+ ,而Fe 3+ 本身被还原成Fe 2+ 。 2Fe 3+ +Cu==2Fe 2+ +Cu (2)FeCl 3 溶液与铁反应时,根据氧化还原反应的归中规律,生成中间价态Fe 2+ 。 2Fe 3+ +Fe==3Fe 2+ (3)FeCl 3 溶液...
 [注解与辨疑6] 为什么铁有多种可变化合价? 作者:吴键 来源:未知 日期:2016-01-18 16:57:23 点击:6352 所属专题:铁及其化合物 化合价
[注解与辨疑6] 为什么铁有多种可变化合价? 作者:吴键 来源:未知 日期:2016-01-18 16:57:23 点击:6352 所属专题:铁及其化合物 化合价
铁是一种极为重要的过渡元素。铁在不同化合物中有多种可变化合价,究其原因,要从铁的原子结构来认识。 铁位于元素周期表第四周期第Ⅷ族,原子序数是26。铁原子的外围电子层排布为3d 6 4s 2 。铁在化学反应时,铁原子最外层4s轨道上的两个电子容易失去使铁显+2价。但次...
 [注解与辨疑6] 铁的氧化物的生成条件 作者:郝军 来源:未知 日期:2020-12-23 20:57:53 点击:5371 所属专题:铁的氧化物
[注解与辨疑6] 铁的氧化物的生成条件 作者:郝军 来源:未知 日期:2020-12-23 20:57:53 点击:5371 所属专题:铁的氧化物
紧密块状的铁在150℃跟干燥空气中的氧不起反应,如灼烧至500℃就形成Fe 3 O 4 ;温度再高,可形成Fe 2 O 3 ;在更高的温度下加热Fe 2 O 3 (约在1400℃以上)时,可失去氧,又得到Fe 3 O 4 。 铁跟纯净的氧气反应,也不能得到纯净的氧化亚铁,这是因为氧化亚铁只有在高温...
 [注解与辨疑6] 明矾的净水作用 作者:孙法军 来源:未知 日期:2012-05-17 10:54:23 点击:8362 所属专题:明矾 水的净化
[注解与辨疑6] 明矾的净水作用 作者:孙法军 来源:未知 日期:2012-05-17 10:54:23 点击:8362 所属专题:明矾 水的净化
天然水中常含有很多细小的悬浮物(细菌、藻类、原生动物、泥沙、粘土及其它不溶性物质)、胶体物质(如腐殖质胶体等)和一些可溶性的盐类、气体等。在除去悬浮物时,常用明矾或硫酸铝等凝聚剂,使这些杂质聚集起来,形成较大的颗粒而沉淀。 明矾[KAl(SO4) 2 ·12H 2 O]是硫酸钾...
 [注解与辨疑6] 合金的性质和分类 作者:黄勇 来源:未知 日期:2022-11-29 08:45:43 点击:11268 所属专题:合金
[注解与辨疑6] 合金的性质和分类 作者:黄勇 来源:未知 日期:2022-11-29 08:45:43 点击:11268 所属专题:合金
将两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质叫做合金。 合金比它的成分金属具有许多优良的物理、化学或机械加工性能。如硬铝(含2.2—4.9%Cu、0.2—1.8%Mg、0.3—0.9%Mn、少量的硅,其余是铝),有良好的机械性能、强度大又便于加工,而且...
 [注解与辨疑6] 有关在硫酸铝钾溶液中滴加氢氧化钡溶液的图像 作者:张珍艳 来源:未知 日期:2017-04-06 17:54:31 点击:8822 所属专题:硫酸铝钾 反应图像 铝反应图像
[注解与辨疑6] 有关在硫酸铝钾溶液中滴加氢氧化钡溶液的图像 作者:张珍艳 来源:未知 日期:2017-04-06 17:54:31 点击:8822 所属专题:硫酸铝钾 反应图像 铝反应图像
在KAl(SO4) 2 溶液中滴加Ba(OH) 2 溶液此过程包括前后两个分反应: 开始时: 2KAl(SO4) 2 +3Ba(OH) 2 ====2Al(OH) 3 ↓+3BaSO 4 ↓+K 2 SO 4 此 加时,发生反应如下: K 2 SO 4 +Al(OH) 3 +Ba(OH) 2 ====BaSO 4 ↓+KAlO 2 +KOH 加时,沉淀量不变,全部为BaSO 4 ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、汞齐——汞是金属溶剂 1、汞齐,是一种汞与几种其他金属所形成的合金。“齐”通“...
Al(OH) 3 具有两性,当它作为弱酸时,脱去一个水分子,即为偏铝酸HAlO 2 ,其钠盐为偏...
课本中出现合金这个科普话题,认点真的学习者自然会想到两个很基本的问题。 1 ,合金...
Fe+nSCN[Fe(SCN)n](3n)+(n=16) 在水溶液中,Fe通常以六水合离子[Fe(H2O)6]形式存在,...
结构不同,一般认为不是同一种物质。 第一:二者结构的区别 ①铝酸 铝酸的化学式为 ,...
合金更完备的定义为:合金是由两种或多种元素组成的物质,其中至少有一种是金属。这些...
铝酸HAlO 铝酸HAlO通常指的就是氢氧化铝Al(OH),它是一种两性氢氧化物,既能与酸反应...
1.冰晶石是如何“助熔”氧化铝的? 氧化铝的熔点太高(2050℃),工业生产中较难获得并...