
|
学习小专题 |

|
学习小专题 |
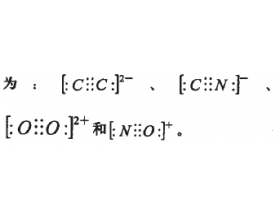 [注解与辨疑e] 浅议等电子原理 作者:邱东兰 来源:未知 日期:2022-11-21 08:48:19 点击:1121 所属专题:等电子体
[注解与辨疑e] 浅议等电子原理 作者:邱东兰 来源:未知 日期:2022-11-21 08:48:19 点击:1121 所属专题:等电子体
等电子原理是现行普通高中课程标准 实验教科书化学选修3《物质结构与性质》 第二章《分子结构与性质》的第一节《共价键》中的一个重要的知识内容。 其概念是这样定义的原子总数相同且 价电子总数也相同的分子或离子具有相同 的结构特征,这个原理就称为“等电子原 理”...
 [注解与辨疑e] 常见的等电子体及其空间结构 作者:鲁志超 来源:未知 日期:2022-11-21 08:41:18 点击:1501 所属专题:等电子体
[注解与辨疑e] 常见的等电子体及其空间结构 作者:鲁志超 来源:未知 日期:2022-11-21 08:41:18 点击:1501 所属专题:等电子体
...
 [注解与辨疑e] 浅析中学十种物质成键情况 作者:罗成 来源:未知 日期:2016-05-09 15:13:36 点击:1305 所属专题:σ键 π键 结构式
[注解与辨疑e] 浅析中学十种物质成键情况 作者:罗成 来源:未知 日期:2016-05-09 15:13:36 点击:1305 所属专题:σ键 π键 结构式
...
 [注解与辨疑e] 氢键知识问答 作者:朱照鹰 来源:未知 日期:2016-04-24 18:02:07 点击:4779 所属专题:氢键02
[注解与辨疑e] 氢键知识问答 作者:朱照鹰 来源:未知 日期:2016-04-24 18:02:07 点击:4779 所属专题:氢键02
氢键是新教材补充的知识点,初学者对氢键 的认识较模糊,现就如何理解有关氢键的几个问题做如下提示。 1.氢键是否只能在H和N、O、F之间形成? 答:不一定。氢键通常用X-H ··· Y表示,其中X、Y代表N、O、F等电负性强、具有弧对电子、原子半径小的非金属原子。除了常规氢...
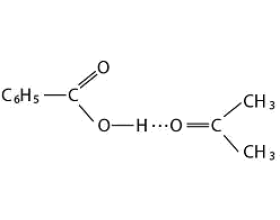 [探讨与扩展a] 氢键概述 作者:马文礼 来源:未知 日期:2016-04-19 10:58:03 点击:4017 所属专题:氢键02
[探讨与扩展a] 氢键概述 作者:马文礼 来源:未知 日期:2016-04-19 10:58:03 点击:4017 所属专题:氢键02
一、氢键的本质 氢原子似乎可以同时和两个电负性很大而原子半径较小的原子(如O、F、N等)相结合,一般表示为X—H…Y,其中H…Y的结合力就是氢键。 关于氢键的本质,直到目前为止还没有圆满的解决。一般认为X—H…Y里,X—H键基本是共价键,而H…Y则是一种强有力的有方向...
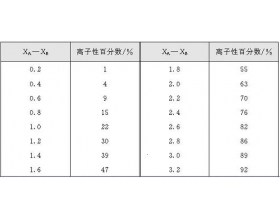 [注解与辨疑e] 键的极性与键的种类判断 作者:代鹏 来源:未知 日期:2016-04-19 09:41:27 点击:6550 所属专题:键的极性 共价键 离子键
[注解与辨疑e] 键的极性与键的种类判断 作者:代鹏 来源:未知 日期:2016-04-19 09:41:27 点击:6550 所属专题:键的极性 共价键 离子键
在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个原子),所以形成的键就具有不同程度的极性。两种元素的电负性相差越大,它们之间键的极性就越强,其中,电负性较大的原...
 [注解与辨疑e] 共价键概述 作者:段文娟 来源:未知 日期:2016-04-19 09:32:43 点击:1278 所属专题:共价键
[注解与辨疑e] 共价键概述 作者:段文娟 来源:未知 日期:2016-04-19 09:32:43 点击:1278 所属专题:共价键
键参数和分子的性质之间有一定的相关性。从键参数的数据可以归纳出某些定性的或半定量的规律用以说明分子的某些性质。所谓键参数指的是用于表征化学键性质的物理量,如键能、键长、键角等物理量的数据。 (1)键能 在101 kPa和25 ℃下,将1 mol理想气体分子AB拆开为中性气态...
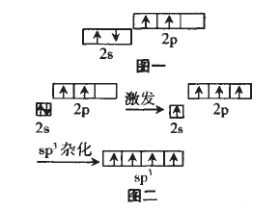 [注解与辨疑e] 浅析杂化轨道理论与价电子对互斥理论的理解与应用 作者:郝凯军 来源:江苏沛县中学 日期:2016-04-01 11:43:39 点击:3362 所属专题:杂化轨道理论 价电子对互斥理论
[注解与辨疑e] 浅析杂化轨道理论与价电子对互斥理论的理解与应用 作者:郝凯军 来源:江苏沛县中学 日期:2016-04-01 11:43:39 点击:3362 所属专题:杂化轨道理论 价电子对互斥理论
杂化轨道理论与价电子对互斥理论是 高中选修化学《物质结构与性质》中的重点 与难点,并且这部分教材对很多教师来说 还是崭新的内容,笔者对于这部分内容有 一些体会,想与大家分享。 一、轨道进行杂化的原因 原子为了更好的成键。这里的“更好” 包括“更多”和“更强...
 [注解与辨疑e] 杂化轨道理论在高中化学中的应用 作者:黄晓东 来源:甘肃武威三中 日期:2016-03-19 22:15:05 点击:1085 所属专题:杂化轨道理论
[注解与辨疑e] 杂化轨道理论在高中化学中的应用 作者:黄晓东 来源:甘肃武威三中 日期:2016-03-19 22:15:05 点击:1085 所属专题:杂化轨道理论
...
 [注解与辨疑e] 氢键释疑 作者:栾凯 来源:未知 日期:2016-03-17 10:36:44 点击:4162 所属专题:氢键02
[注解与辨疑e] 氢键释疑 作者:栾凯 来源:未知 日期:2016-03-17 10:36:44 点击:4162 所属专题:氢键02
问题1:氢键是如何形成的? 答:形成氢键是H特有的性质,半径很小的 H与电负性大的X形成共价键后,由于X吸引价 电子能力大,使H几乎成为“裸露”的质子,由于质子的半径特别小(30pm),可以与另一个具有孤对电子的电负性大的Y相互作用形成Z—H Y 氢键。 问题2:决定氢键强弱的因...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱作用力的“强作用”---- 《物质结构与性质》苏教版134学科提炼 微粒间的作用力类型...
2023年湖南卷16题的第(5)问(见图一), 第(5)问 “ 引发剂 C 6 H 5 CH 2 Cl 、 C ...
硫氰根离子(SCN)与金属离子形成配位键时,硫原子和氮原子都有可能给出电子对。 当和一...
在化学中均裂和异裂是共价键的断裂的两种主要方式,其决定因素不同:均裂主要由键能决...
【导读】分子内氢键特指同一分子内形成的氢键,常构成五元或六元环结构,如水杨醛、水...
...
关于高氯酸(HClO)酸性强于硝酸(HNO)的化学原理解析,主要从以下几个方面进行了详...
相关知识: 1、极性键和非极性键: 在化合物分子中,不同种原子形成的共价键,由于两...