1. 电解质与非电解质 化学上把在水溶液里或熔融状态下能导电的化合物称为电解质,凡是在此条件下都不能导电的化合物都称为非电解质。在这里应注意两个状态是指水溶液和熔融态,熔融态是指物质高温时的纯液态;或是指电解质在两个状态中只要有一个状态下导电即可,不一
1. 电解质与非电解质
化学上把在水溶液里或熔融状态下能导电的化合物称为电解质,凡是在此条件下都不能导电的化合物都称为非电解质。在这里应注意两个“状态”是指水溶液和熔融态,熔融态是指物质高温时的纯液态;“或”是指电解质在两个状态中只要有一个状态下导电即可,不一定两个状态都必须能导电。若两个状态下都不能导电的化合物则为非电解质,如:酸只能在水溶液中导电,不能在液态时导电,但其仍属电解质;“能导电”是指电解质在定义中的状态下可以导电,而非它本身可以导电,如:属于电解质的酸在固态和液态时不能导电,属于电解质的碱和盐在固态时也不能导电;“化合物”是指电解质、非电解质必须一定是纯净物,不能是混合物(如:溶液)或单质(如金属单质)。同时还应注意电解质必须是由其本身电离出离子来导电才行,否则就不属于电解质,如:许多酸性氧化物、氨气溶于水时所得的水溶液能导电,但它们不是电解质,因为它们溶于水后与水反应生成的酸(H2SO3、H2SO4、H2CO3)、NH3·H2O电离出阴、阳离子,并非是来自酸性氧化物(如SO2、SO3、CO2等)、氨气,因此它们不是电解质,而只能是非电解质。常见的电解质有水、酸、碱、盐及金属氧化物等,非电解质有非金属氧化物及大多数有机物。
2. 强电解质与弱电解质
电解质在水溶液或熔化状态下离解成自由移动的离子的过程叫电离。我们把在水溶液里能完全电离的电解质称为强电解质,不能完全电离的电解质称为弱电解质。因而强电解质所形成的溶液中含有阴、阳离子,没有溶质分子;弱电解质形成的溶液中除含有阴、阳离子外,还含有溶质分子。常见的强电解质有强酸、强碱及大多数的盐等,弱电解质有弱酸、弱碱、水及少数的盐等。注意强弱电解质的划分与电解质的溶解能力无关,只与其溶于水的部分是否完全电离有关。如CaCO3、BaSO4等不溶性电解质,由于它们溶于水的那一点点能彻底电离,因而它们就是强电解质,其电离方程式分别为: 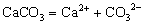 、
、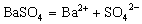 ;再如CH3COOH尽管易溶于水,但由于CH3COOH仅有部分电离出H+、CH3COO-,因而CH3COOH属于弱电解质,其电离方程式则为:CH3COOH
;再如CH3COOH尽管易溶于水,但由于CH3COOH仅有部分电离出H+、CH3COO-,因而CH3COOH属于弱电解质,其电离方程式则为:CH3COOH 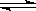 H+ + CH3COO-。再就是溶液的导电能力强弱与电解质的强弱无必然关系,而是与溶液中的离子浓度及离子所带的电荷数有关,离子浓度越大、离子所带的电荷数越多,则溶液的导电能力越强。
H+ + CH3COO-。再就是溶液的导电能力强弱与电解质的强弱无必然关系,而是与溶液中的离子浓度及离子所带的电荷数有关,离子浓度越大、离子所带的电荷数越多,则溶液的导电能力越强。
3. 典例解析
例1. 下列叙述正确的是( )
A. 液态HCl、固态NaCl均不导电,所以HCl和NaCl均为非电解质
B. NH3、SO3的水溶液均导电,所以NH3、SO3是电解质
C. 铜丝、石墨均导电,所以它们是电解质
D. 蔗糖、酒精在水溶液中或熔融时均不导电,所以它们是非电解质
答案:D
解析:(1)电解质不是在所有状态下都能(电离成自由移动的离子)导电,只要在水溶液中或熔融状态下能电离的化合物都是电解质;在上述情况下都不能电离的化合物即为非电解质,故A错误、D正确;(2)电解质是溶于水或熔融状态能电离出自由移动离子的化合物。B选项错误,原因如前面所述。(3)电解质、非电解质都是化合物,单质不属于该问题范畴,故C错。
例2. 仅能在水溶液中导电的电解质是( )
A. NaOH B. SO3 C. NaHCO3 D. H2SO4
答案:CD
解析:酸、碱、盐都是电解质。碱、盐大多数为离子化合物,在溶于水或熔融状态下都能导电;而酸为共价化合物,液态时(纯物质)不存在离子,因此仅在溶于水状态下导电。在氧化物中:酸酐溶于水生成酸而能导电,酸是电解质,但酸酐不是电解质。如SO3溶于水生成硫酸能导电,硫酸是电解质而SO3不是电解质;若碱性氧化物为离子化合物,溶于水则生成的碱能导电,其熔融状态下也能导电,因而碱性氧化物和其对应的碱均为电解质。如氧化钠为离子化合物,其溶于水生成的氢氧化钠能导电,其在熔融状态下也能导电;若碱性氧化物为离子化合物,即使不溶于水,其在熔融状态下能导电,该碱性氧化物也是电解质。如氧化铝为离子化合物,是电解质,其熔融状态下就能导电。本题讨论的是仅能在水溶液中导电的电解质,除了酸类物质外,还存在仅能在水溶液中存在的物质(如NH3·H2O、H2CO3)和熔融状态下分解的物质(如碳酸氢钠、碳酸氢铵等)。
例3. 下列化合物中都是弱电解质的一组是( )
A. CuSO4、NaCl、HNO3、K2SO4
B. H2CO3、CH3COOH、H3PO4、NH3·H2O
C. K2S、BaSO4、AgCl、NaOH
D. H2O、HCl、Na2CO3、SO2
答案:B
解析:本题主要考查强、弱电解质的概念及常见强电解质和常见弱电解质的掌握情况。因而对常见的强酸、强碱、弱酸、弱碱等要熟记,尤其是常见的弱酸、弱碱,像H2CO3、CH3COOH、H3PO4、NH3·H2O、H2S、HClO等弱电解质要掌握。
例4. 将4.0g氢氧化钠固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是( )
A. 自来水 B. 3.65g HCl C. 6.0g醋酸 D. 5.35g NH4Cl
答案:BD
解析:溶液的导电能力主要取决于溶液中离子浓度的大小,离子浓度越大,则溶液的导电能力越强。水是极弱的电解质,其电离出的离子很少,因而其离子浓度很低,导电能力极弱。HCl是弱酸,氯化铵是易溶于水的盐,都属于强电解质,全部电离,因而其溶液中离子浓度较高,导电能力很强。醋酸是弱酸,弱电解质,部分电离,因而其溶液中离子浓度不大,导电能力不强。当4.0g氢氧化钠固体分别加入下列100mL溶液中(液体的体积变化可忽略不计),4.0g氢氧化钠与选项B、C、D中的物质恰好完全反应。溶液的性质则发生如下变化:A项水中加入了氢氧化钠后,由于氢氧化钠是强碱,全部电离后,离子浓度变化很大,故导电能力变化很大,与B项中盐酸反应生成氯化钠,氯化钠与盐酸相当,故其导电能力变化很小;选项C中的醋酸,原先只部分电离,当氢氧化钠与醋酸反应生成醋酸钠(强电解质),溶于水全部电离,离子浓度变化很大,故导电能力变化很大;选项D中的氯化铵和氢氧化钠反应生成氯化钠和氨,氯化钠代替了原氯化铵,氨水是弱电解质,微弱电离(1%左右),所以溶液中离子浓度变化不大,导电能力变化不大。
(责任编辑:化学自习室)



 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。