
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、电化学腐蚀的分类——钢铁的电化学腐蚀
| 类型 | 析氢腐蚀(腐蚀过程中不断有氢气放出) | 吸氧腐蚀(反应过程吸收氧气) | |
示意图 |
|
| |
条件 | 水膜酸性较强 | 水膜酸性很弱或呈中性 | |
电极材料及反应 | 负极(Fe) |
|
|
正极(碳) |
|
| |
总反应 |
|
| |
联系 | 吸氧腐蚀更普遍 | ||
二、电化学腐蚀的实验探究
1、实验探究一
| 实验过程 | 将经过酸洗除锈的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。几分钟后,观察导管中水柱的变化,并解释引起这种变化的原因 |
示意图 |
|
实验现象 | 导管中液面上升 |
实验解释 | 装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀 |
2、实验探究二
| 实验过程 | 取两支试管,分别放入两颗锌粒和等体积、等浓度的稀盐酸,观察现象。然后,向其中一支试管中滴加1~2滴硫酸铜溶液,再观察现象,并解释引起这种变化的原因 |
示意图 |
|
实验现象 | 开始时试管中均有无色气体产生,滴加硫酸铜溶液后产生气体的速率明显加快 |
实验解释 | Zn与CuSO4反应生成Cu,Zn、Cu和稀盐酸构成原电池,形成电化学腐蚀,速率更快 |
3、判断金属腐蚀快慢的规律
(1)同一金属在相同电解质溶液中,金属腐蚀的快慢:电解原理引起的腐蚀(即电解池的阳极)>原电池原理引起的腐蚀(即原电池的负极)>化学腐蚀>有防腐措施的腐蚀(即电解池的阴极、原电池的正极及加有镀层的金属等)
(2)同一金属在不同电解质溶液中,金属腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液
(3)活动性不同的两种金属,活动性越强,腐蚀得越快
(4)同一金属在相同电解质溶液中,电解质浓度越大,腐蚀越快
三、电化学防护法
1、牺牲阳极的阴极保护法
| 原理 | 利用原电池原理,让被保护金属做正极,一种活泼性较强的金属做负极,用导线相连 |
|
要求 | 被保护的金属作正极,活泼性更强的金属作负极 | |
应用 | 锅炉内壁、船舶外壳、钢铁闸门安装镁合金或锌块 |
(1)实验探究一
以Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液作电解质溶液,观察电流表指针的变化,以及烧杯中两个电极附近发生的现象。过一段时间,用胶头滴管从Fe电极区域取少量溶液于试管中,再向试管中滴加2滴K3[Fe(CN)6](铁氰化钾)溶液,观察试管中颜色的变化。
已知:Fe2+与[Fe(CN)6]3-反应生成带有特征蓝色的铁氰化亚铁沉淀:
![]()
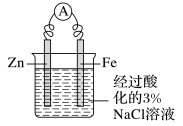
实验装置 | 电流表 | 阳极(负极区) | 阴极(正极区) |
现象 | 指针偏转 | Zn溶解 | 有气泡产生,无蓝色沉淀生成 |
有关反应 | — |
|
|
结论 | 溶液中不含Fe2+,铁作正极未被腐蚀 | ||
(2)实验探究二
| 实验过程 | 将1 g 琼脂加入250 mL 烧杯中,再加入50 mL 饱和食盐水和150 mL 水。搅拌、加热煮沸,使琼脂溶解。 稍冷后,趁热把琼脂溶液分别倒入两个培养皿中,各滴入5~6滴酚酞溶液和K3[Fe(CN)6]溶液,混合均匀。取两个2~3 cm的铁钉,用砂纸擦光。 如图(A)所示,将裹有锌皮的铁钉放入上述的一个培养皿中;如图(B)所示,将缠有铜丝的铁钉放入另一个培养皿中,观察并解释实验现象 | |
实验装置 |
|
|
实验现象 | 铁钉周围变红 | 铁钉周围生成蓝色沉淀,铜丝周围变红 |
实验结论 | 铁作为负极时易腐蚀,作为正极时未腐蚀 | |
2、外加电流的阴极法
| 原理 | 利用电解池原理,把被保护的钢铁设备作为阴极,用惰性电极作为辅助阳极,两者均放在电解质溶液里,接外加直流电源。通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零。在这个系统中,钢铁设备被迫成为阴极而受到保护 |
|
要求 | 被保护的金属作为阴极,与电源的负极相连 | |
应用 | 钢铁闸门,高压线铁架,地下管道连接直流电源的负极 |
(3)两种保护方法的比较:外加电流法保护效果大于牺牲阳极法

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。《电解原理及其应用》是电化学知识的一个重要组成部分,但新教材将这一部分知识内容放...
一、理解掌握原电池和电解池的构成条件和工作原理 二、掌握电解反应产物及电解时溶液p...
...
一.原电池构成的基本条件 水往低处流,因为存在差异,高低差异。一杯热水与一杯冷水...
...
...