
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
用图表来表述化学转化过程或进行定性分析与定量计算,不仅是化学的基本表达方式,而且是将化学问题简约化的好办法。有一类涉及多个反应的图象题就是考查以上两种能力,这类题往往将数据处理与化学问题融为一体,信息量大,难度也大。
此类题的解题策略是认真观察理解图表所呈现的化学含义,准确把握所涉及的化学反应原理,并关注化学反应的先后顺序与图象中显示的定量关系,从中提炼出相关的解题信息从而有序解决化学问题。
【例1】取等物质的量浓度的NaOH溶液两份A和B,每份50 mL,向其中各通入一定量的CO2,然后各取溶液10 mL,分别将其稀释为100 mL,分别向稀释后的溶液中逐滴加入0.1mol·L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示。
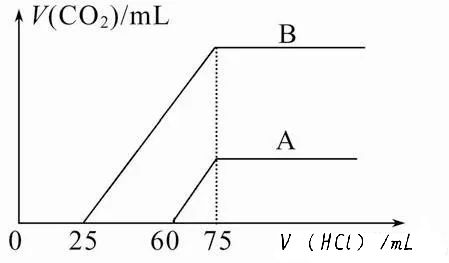
试回答下列问题:
(1)原NaOH溶液的物质的量浓度为_______。
(2)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为________(写化学式),其物质的量之比为_________;加盐酸后产生CO2体积的最大值为______mL(不考虑CO2的溶解,下同)。
(3)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为___________(写化学式),其物质的量之比为__________。
【定性分析】向NaOH溶液中通入CO2时,所得溶液中的溶质可能有四种情况:①只有Na2CO3,②只有NaHCO3,③Na2CO3与NaHCO3,④Na2CO3与NaOH。而NaOH、Na2CO3、NaHCO3分别与HCl发生离子反应所涉及到的三个离子方程式先后顺序:OH-+H+==H2O,CO32-+H+==HCO3-,HCO3-+H+==CO2↑+H2O,符合碱性强的微粒先与H+反应的原则。
由三个反应式可知:若只有NaHCO3与盐酸反应,则图象上的曲线应从原点开始放出CO2气体,不合题意。若只有Na2CO3与盐酸反应,则图象上的曲线应从原点开始一段未放出CO2气体,而后又一段放出CO2气体,且横坐标上这两段是等距离的,题设没有这种情况。题设的曲线a未放出CO2气体的这段数据(盐酸用量)60mL大于放出CO2气体的这段数据(盐酸用量)15mL,表明曲线a的溶质为NaOH和Na2CO3。而题设的曲线b未放出CO2气体的这段数据(盐酸用量)25mL小于放出CO2气体的这段数据(盐酸用量)50mL,表明曲线a的溶质为Na2CO3和NaHCO3。
【定量计算】由图象可知75 mL 盐酸时产生CO2体积最大,即此时溶液中溶质为NaCl,根据Na+、Cl-离子守恒可得c(NaOH)=0.75mol·L-1。
由曲线A横坐标显示的盐酸用量知:NaOH消耗盐酸75 mL-2×15 mL =45 mL,Na2CO3转化为NaHCO3消耗盐酸15 mL,因离子方程式中定量关系均为1∶1,且盐酸是同浓度,故n(NaOH)∶n(Na2CO3) =45∶15 =3∶1;V(CO2)=0.1mol·L-1×0.015L×22.4L·mol-1=0.0336 L=33.6 mL。
由曲线B横坐标显示的盐酸用量知:Na2CO3消耗盐酸25 mL,Na2CO3转化的NaHCO3消耗盐酸也是25 mL,原NaHCO3消耗盐酸75 mL-2×25 mL =25 mL,故n(Na2CO3)∶n(NaHCO3) =25∶25 =1∶1。
【答案】
(1)0·75mol·L-1
(2)NaOH Na2CO3 n(NaOH)∶n(Na2CO3)=3∶133.6
(3)Na2CO3、NaHCO3 n(Na2CO3)∶n(NaHCO3)=1∶1
【例2】将某稀硫酸和稀硝酸的混合溶液200mL 平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸均只被还原为NO气体)。下列分析或结果不正确的是( )
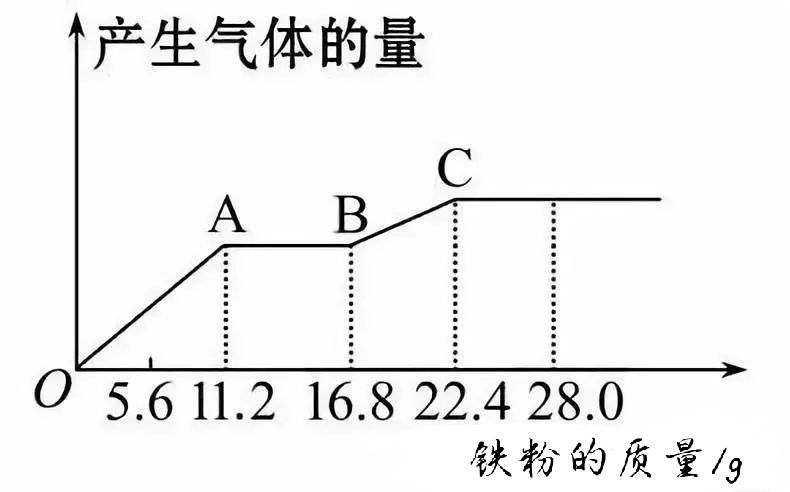
A.第二份溶液中最终的溶质为FeSO4
B.OA段产生的气体是NO,AB段的反应为:Fe+2Fe3+=3Fe2+,BC段产生的气体是H2
C.原混合酸中NO3-的物质的量共为0.4 mol
D.原混合酸中H2SO4的物质的量浓度为5mol·L-1
【定性分析】在第二份稀硫酸和稀硝酸的混合液中,逐渐加入铁粉发生氧化还原反应的所涉及到的三个离子方程式先后顺序为:
OA段Fe+4H++NO3-==Fe3++NO↑+2H2O,
AB段Fe+2Fe3+==3Fe2+,
BC段Fe+2H+==Fe2++ H2↑,符合氧化性强的微粒先与Fe反应的原则。
结合三个反应式和图示数据知:C点反应完全结束,消耗22.4 g Fe,最终溶液为FeSO4溶液,无NO3-剩余。故A、B两选项均正确。
【定量计算】根据SO42-、和Fe元素守恒得:n(H2SO4)=n(FeSO4)= n(Fe) =22.4 g÷56 g·mol-1=0.4 mol,c(H2SO4)=0.4 mol÷0.1 L=4mol·L-1,故D项不正确。达到A点时铁刚好将NO3-耗完,由OA段离子反应方程式知:n(NO3-)=n(Fe)=11.2 g÷56 g·mol-1=0.2 mol,原溶液中n(NO3-)=0.4 mol,故C项正确。
【答案】D
【训练1】向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是()
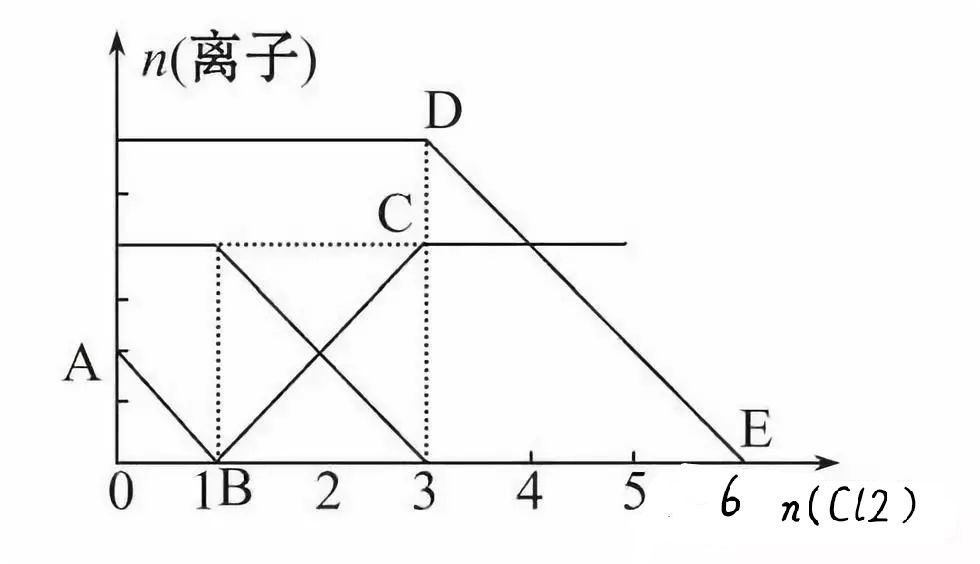
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++ 2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+)∶N(I-)∶N(Br-)=2∶1∶3
【提示:图象中的化学含义】三种离子的还原性强弱顺序为:I-、Fe2+、Br-,分别与氯气发生氧化还原反应的先后顺序是:2I-+ Cl2==2Cl-+I2(图示Ab线段),2Fe2++ Cl2==2Cl-+2Fe3+(图示BC线段),2Br-+ Cl2==2Cl-+ Br2(图示DE线段)。
【答案】B
【训练2】现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之( )
A.1∶1∶4 B.1∶3∶1 C.3∶3∶8 D.1∶1∶1
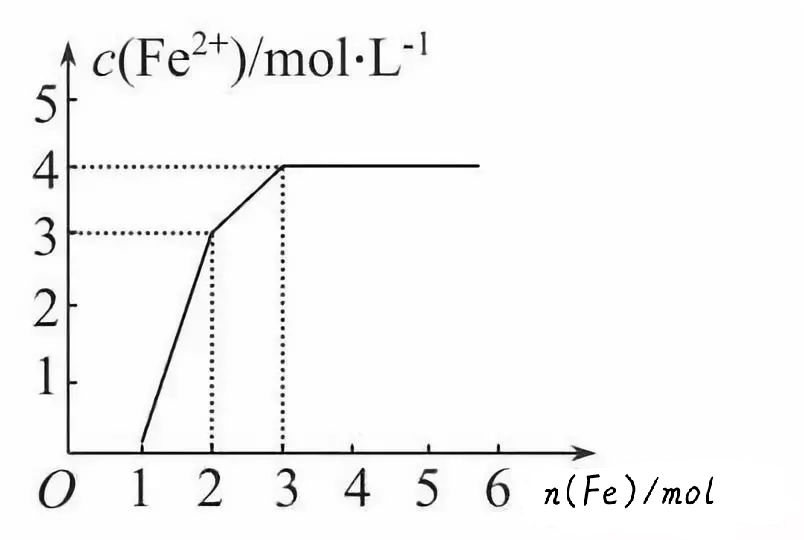
【提示:图象中的化学含义】三种物质及微粒的氧化性强弱顺序为:HNO3>Fe3+>Cu2+,分别与铁粉发生氧化还原反应的先后顺序是:Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O(图中横坐标0~1线段),Fe+2Fe(NO3)3==3Fe(NO3)2(图中横坐标1~2线段),Fe+Cu(NO3)2==Fe(NO3)2+Cu(图中横坐标2~3线段)。
【答案】A
【训练3】有一定质量的Mg、Al合金,投入100mL 一定物质的量浓度的盐酸溶液中,金全部溶解,向所得溶液中滴加5mol·L-1NaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求(1)原合金中Mg、Al的质量各是多少?(2)HCl的浓度是多少?
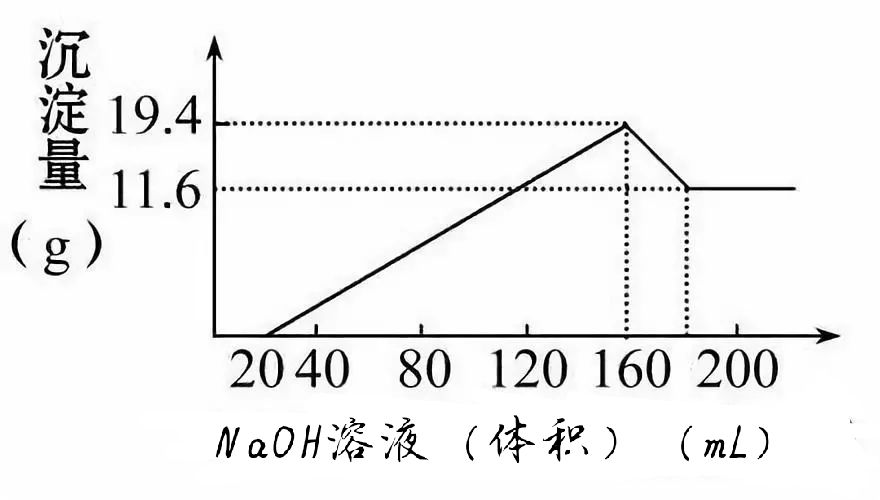
【提示:图象中的化学含义】Mg、Al合金完全溶于盐酸后的混合液含:H+、Mg2+、Al3+,滴加NaOH溶液至过量反应的先后顺序为:OH-+H+==H2O(图示横坐标0~20线段),3OH-+Al3+==Al(OH)3↓和2OH-+Mg2+==Mg(OH)2↓(图示横坐标20~160线段)Al(OH)3+OH-==[ Al(OH)4]-(图示横坐标160~200线段)。纵坐标11.6 g 是Mg(OH)2的质量,19.4 g-11.6 g=7.8 g 是Al(OH)3的质量。
【答案】(1)Mg、Al质量各为4.8 g、2.7 g (2)8 mol/L
【训练4】向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):
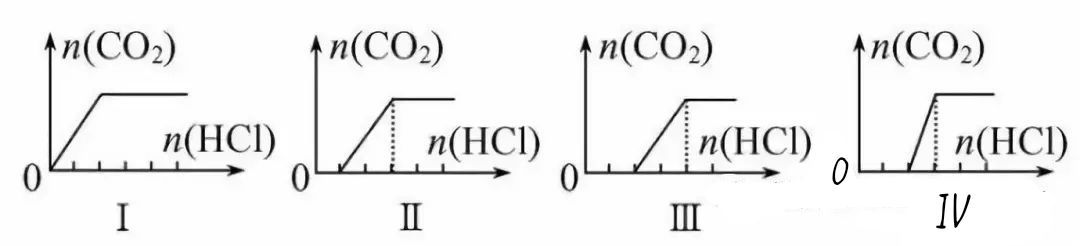
下列分析都正确的组合是( )
溶液组成主要成分 | 对应图像 | 溶液中离子浓度关系 | |
A | Na2CO3、NaHCO3 | Ⅰ | c(Na+)=c(HCO3-) |
B | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)<c(HCO3-) |
C | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
D | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+ c(HCO3-)+c(H2CO3) |
【提示:图象中的化学含义】NaOH、Na2CO3或NaHCO3混合体系与HCl反应的先后顺序:OH-+H+==H2O,CO32-+H+==HCO3-,HCO3-+H+==CO2↑+H2O;设未产生气体时消耗盐酸的体积为V1,产生CO2气体时消耗盐酸的体积为V2,由图Ⅰ可知,开始就有CO2生成,故溶质应为NaHCO3;由图Ⅱ知,开始无CO2生成,且V2=2V1,可知溶质为Na2CO3和NaHCO3;由图Ⅲ可知,V1=V2,所以溶质为Na2CO3;由图Ⅳ知,V1=2V2,溶质为NaOH、Na2CO3。
【答案】B
【训练5】将足量的CO2不断通入KOH、Ba(OH)2、K[Al(OH)4]的混合溶液中,生成沉淀的物质的量与通入CO2的体积的关系可表示为()
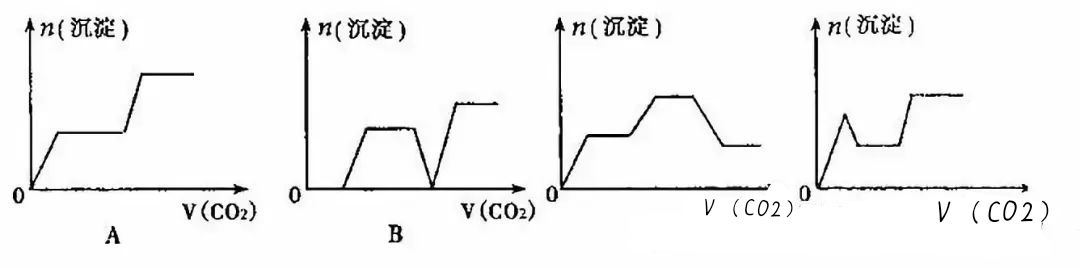
【提示:图象中的化学含义】
通入CO2发生反应的先后顺序为:①CO2+Ba(OH)2==BaCO3↓+H2O;②CO2+2KOH==K2CO3+H2O;③CO2+2K[A1(OH)4]==K2CO3+H2O+2Al(OH)3↓;④CO2+K2CO3+H2O==2KHCO3;⑤BaCO3+CO2+H2O==Ba2++2HCO3-。
【答案】C
通过以上解题训练,不仅可以提高识图能力,而且可以达到优化思维的目的。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。热重曲线 ”类试题注重学生能力的考查 , 是近年命题的热点 . 试题一般以图像和文字组...
有些体系不只涉及一个反应,并且不同的反应之间存在着某种相互联系,对于这样的体系,...
“1”在数学里是个令人很关注的数字,它简单又特殊,透过简单可解决复杂问题。在化学...
某些反应容器中同时发生几个反应,且不同的反应之间存在着这样的关系:前个反应的产物...
守恒思想贯穿着中学化学始终,守恒法的灵活运用能够简化解题过程,从而快速准确地解答...
论述化学反应方程式计算技巧的文字很多,但论及计算思想的不多。能否把众多的涉及化学...