
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机制备实验是一类以有机物的制备为载体, 综合考査学生基础实验知识和基本实验技能的题型。这类题型内容科学,素材来源真实,能体现化学的应用价值。同时题目情境新颖、信息量大,但考查的落脚点又是高中学生必备的基础知识和基本技能,能很好地体现考试大纲中考査学生“接受、吸收、整合化学信息的能力”。因此,近几年,有机制备实验成了高考命题的热点,也是我们在高考复习中必须 突破的重点和难点。
―、有机制备实验的考査方式
制备一种有机物,首先要通过选择正确的制备路线和合适的反应装置来制备合成。由于制备的物质往往是混有过量的反应物及副产物的混合物,还 需要通过适当的手段对物质进行分离和提纯,才能得到纯度较高的产品。即有机制备实验往往包括两个过程:制备合成和分离纯化。有机制备实验题也往 往是对这两个过程中涉及的知识和技能的考查。
具体来说,主要有:
1.制备合成过程中,可能考查的内容有:反应原理,合成路线的选择与评价,可能的副反应;反应装 置的选择,仪器识别,装置作用分析;加料顺序;反应条件的控制等。
2.物质的分离提纯过程中,可能考查的内容有:可能混有的杂质;杂质的产生原理;除杂试剂,所加 试剂的作用;除杂方法;操作细节等。
此外,制得目标产物后,还可能考査定性的检验,产率的计算或是纯度的测定等。
二、有机制备实验的应对策略
1. 了解有机物制备合成的常见实验装置
若所制备的是气体物质,就选用气体发生装置, 这是学生较熟悉的,本文中不再对此进行赞述;若所 制备的是固体或液体物质,则需要根据反应条件、反应原料和反应产物的性质等选择合适的发生装置。
总的来看,根据反应产物与反应原料的沸点差异,制备装置可以分为两类:蒸馏装置和回流装置, 回流装置更常见。一般产物的沸点明显低于反应原料的沸点,可选择蒸馏装置,如乙酸乙酯的制备,及时地将产物蒸出有利于化学平衡正向移动从而提髙 产率;如果产物的沸点高于反应原料的沸点,则多采 用回流装置,如硝基苯的制备,因为有机制备实验往 往反应时间长,反应原料易挥发,采用回流装置能减 少原料的损失。
蒸馏装置和回流装置均主要由反应容器和冷凝 管组成。常见反应容器有圆底烧瓶、双颈烧瓶或三颈 烧瓶等。冷凝管常见的有直形冷凝管、球形冷凝管、 蛇形冷凝管和空气冷凝管,使用时需要根据用途及 反应混合物的沸点高低来选择。蒸馏时多用直形冷 凝管,但当被加热的液体沸点髙于140℃时,可选用 空气冷凝管,以免冷凝管通水冷却时导致玻璃温差 大而炸裂。回流时一般多选用球形冷凝管,其受热面积大,冷凝效果好。若被加热的液体沸点很低或其中 有毒性较大的物质时,则可选用蛇形冷凝管,以提高冷却效率。
此外,根据反应的不同,还可在反应容器上装配 其他仪器,如温度计、搅拌器、滴加液体的分液漏斗、 干燥管、分水器等,如果反应中有气体生成,还必须有气体吸收装置。
2. 分析产品中的杂质,掌握有机物分离提纯的 一般步驟和方法
要想快速读懂题中提纯步骤,必须先弄清楚产品中有何杂质。制得的产品中的杂质主要有三个来 源:一是未反应完全的原料,包括催化剂;二是生成 物中除产物外的其他物质;三是副反应产物。
(1) 液体产物的纯化
液体产品的提纯往往包括粗分离和精分离两个 提纯过程。在粗分离过程中,通常是三个步骤:
第一 步水洗,目的是洗去大部分易溶于水的杂质;
第二步 无机试剂洗涤,目的是洗去容易与无机试剂反应的 杂质,如乙酸乙酯的制备中用饱和如Na2CO3溶液洗去 乙酸,制取溴苯后加NaOH溶液洗去液溴等;
第三步 再水洗,洗去第二步中加入的无机试剂。每一次洗涤 后均需分液。
精分离一般是在粗分离后,向粗产品中 先加干燥剂除去微量水,再蒸馏,收集温度为产物沸 点的馏分,即得到较高纯度的产品。
(2) 固体产物的纯化
固体粗产物可用过滤、重结晶等方法来精制。
除了了解有机物分离提纯的一般步骤,还必须 掌握过滤、分液、蒸馏、重结晶等物质分离提纯的基 本方法。化学是一门以实验为基础的学科,《课程标准》特别注重学生实验技能的培养,考试大纲强调对 学生实验技能的考查,那高考试题中定会深入考查。
3. 熟悉计算产率及对实验进行分析评价的方法
在这类考题中,制得产品后通常会计算产率。在计算时,要判断过量,将不足量的反应物的量代入化 学方程式,计算出产物的理论产量:产率=实际产量/ 理论产量×100%。
物质制备实验的实际产量往往达不到理论值, 在对实验进行评价时,可以从以下几方面考虑:
(1) 反应原理:反应可逆,反应物不可能全部转化成产 物;有副反应发生,一部分原料消耗在副反应中。
(2) 实验操作:在制备反应中,若反应时间不足、温度控 制不好或搅拌不够充分等都会引起实验产率降低;
(3)分离和提纯过程中也可能造成较大的损失。
有机制备实验之所以是学生的难点,主要在于学生对此比较陌生。同时,由于教材中关于有机实验 的篇幅实在太少,教师在教学中往往是碰到题目就题讲题,导致学生面对新的情境只有招架之势,无法 迁移。教师在教学中适当进行有体系的拓展,让学生 知道有机制备实验的一般步骤,认识有机实验中的 常见仪器,加上学生已有的分离提纯知识和有机化 合物知识,题目情境不再陌生,此类题型便不再是 难点。
【真题再现】
1.[2019新课标Ⅱ] 咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10−6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
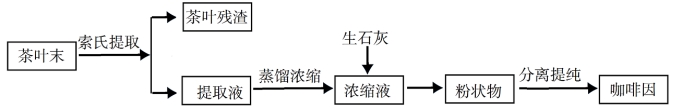
索氏提取装置如图所示。实验时烧瓶中溶![]() 剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
⑴实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
⑵提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的优点是______________。
⑶提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是______。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有_______(填标号)。
A.直形冷凝管 B.球形冷凝管 C.接收瓶 D.烧杯
⑷浓缩液加生石灰的作用是中和_______和吸收_______。
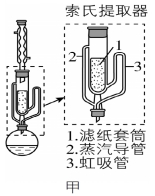
⑸可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
【答案】⑴增加固液接触面积,提取充分 沸石
⑵乙醇易挥发,易燃 使用溶剂量少,可连续萃取(萃取效率高)
⑶乙醇沸点低,易浓缩 AC ⑷单宁酸 水 ⑸升华
【解析】⑴萃取时将茶叶研细可以增加固液接触面积,从而使提取更充分;由于需要加热,为防止液体暴沸,加热前还要加入几粒沸石;
⑵由于乙醇易挥发,易燃烧,为防止温度过高使挥发出的乙醇燃烧,因此提取过程中不可选用明火直接加热;根据题干中的已知信息可判断与常规的萃取相比较,采用索式提取器的优点是使用溶剂量少,可连续萃取(萃取效率高);
⑶乙醇是有机溶剂,沸点低,因此与水相比较乙醇作为萃取剂的优点是乙醇沸点低,易浓缩;蒸馏浓缩时需要冷凝管,为防止液体残留在冷凝管中,应该选用直形冷凝管,而不需要球形冷凝管,A正确,B错误;为防止液体挥发,冷凝后得到的馏分需要有接收瓶接收馏分,而不需要烧杯,C正确,D错误,答案选AC。
⑷由于茶叶中还含有单宁酸,且单宁酸也易溶于水和乙醇,因此浓缩液中加入氧化钙的作用是中和单宁酸,同时也吸收水;
⑸据已知信息可知咖啡因在100℃以上时开始升华,因此该分离提纯方法的名称是升华。
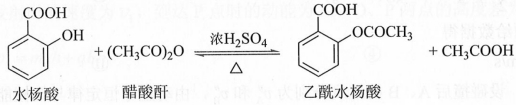
2.[2019新课标Ⅲ]乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作。
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
⑴该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
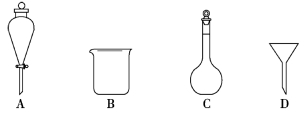
⑵下列玻璃仪器中,①中需使用的有_____(填标号),不需使用的_______(填名称)。
⑶①中需使用冷水,目的是______________________________________。
⑷②中饱和碳酸氢钠的作用是_______________________,以便过滤除去难溶杂质。
⑸④采用的纯化方法为____________。
⑹本实验的产率是_________%。
【答案】⑴A ⑵BD 分液漏斗、容量瓶 ⑶充分析出乙酰水杨酸固体(结晶)⑷生成可溶的乙酰水杨酸钠 ⑸重结晶 ⑹60
【解析】⑴因为反应温度在70℃,低于水的沸点,且需维温度不变,故采用热水浴的方法加热;
⑵操作①需将反应物倒入冷水,需要用烧杯量取和存放冷水,过滤的操作中还需要漏斗,则答案为:BD;分液漏斗主要用于分离互不相容的液体混合物,容量瓶用于配制一定![]() 浓度的溶液,这两个仪器用不到。
浓度的溶液,这两个仪器用不到。
⑶反应时温度较高,所以用冷水的目的是使得乙酰水杨酸晶体充分析出;
⑷乙酰水杨酸难溶于水,为了除去其中的杂质,可将生成的乙酰水杨酸与碳酸氢钠反应生成可溶性的乙酰水杨酸钠,以便过滤除去杂质;
⑸每次结晶过程中会有少量杂质一起析出,可以通过多次结晶的方法进行纯化,也就是重结晶;
⑹水杨酸分子式为C7H6O3,乙酰水杨酸分子式为C9H8O4,根据关系式法计算得:
C7H6O3~ C9H8O4
138 180
6.9g m
m( C9H8O4)=(6.9g×180)/138=9g,则产率为
![]() 。
。
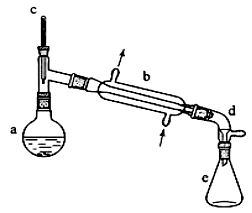
3、 (2013新课标I卷26)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 ________ 。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 ________ 。
(4)分液漏斗在使用前须清洗干净并________ ;在本实验分离过程中,产物应该从分液漏斗的 ________ (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 ________ 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________ (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________ (填正确答案标号)。
A.41% B.50% C.61% D.70%
答案:(1)直形冷凝管 (2)防止暴沸;B
(3)![]()
(4)检漏;上口倒出 (5)干燥(或除水除醇) (6)CD (7)C
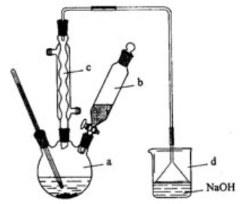
4、(2012·全国新课标卷28)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL,无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体。继续滴加至液溴滴完。装置d的作用是________
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是______
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_________
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中a的容积最适合的是_________(填入正确选项前的字母);
A.25mL B.50mL C.250mL D.500mL
【答案】(1)HBr 吸收HBr和Br2 (2)除去HBr和未反应的Br2 干燥 (3)苯 C (4)B
【解析】本题以溴苯的制取为题材,着重考查考生的实验基本操作能力。
(1)苯与溴在铁屑催化下可生成溴苯和溴化氢,溴化氢不溶于有机溶剂,挥发过程中遇到水蒸气便产生白色烟雾,装置d的作用很明显是吸收反应生成的HBr和挥发出来的Br2。
(2)反应后的混合物中主要有苯、溴苯、溴、溴化铁及少量的HBr,因此NaOH溶液洗涤的目的是除去HBr和剩余的Br2。无水氯化钙具有吸水性,可干燥溴苯。
(3)此时溴苯中含有的杂质主要是苯,要进一步提纯,必须采取蒸馏措施。
(4)反应物的总体积大约19mL,因反应液的体积应为反应容器的1/3~2/3,因此最适合的为B。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
名称 索氏提取器 仪器 主要 用途 索氏提取器就是利用溶剂回流及虹吸原理,使固体物质...
在乙酸乙酯的制备实验中,乙醇、乙酸、浓硫酸加入顺序人教版教材是先乙醇再浓硫酸再乙...
“有机实验”在高考中频频出现,主要涉及有机物的制备、有机物官能团性质的实验探究等...
考点归纳: 1、实验装置(仪器的名称与使用、装置的选择) 2、实验操作技能(条件的控...
有机制备实验是一类以有机物的制备为载体, 综合考査学生基础实验知识和基本实验技能...