
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
Be的第一电离能为什么高于B?有的课堂对此的解释是:Be的价电子为2s2,全满稳定。需要指出的是,这是不准确的解释。本文进行详细阐述。
在同一能级的简并轨道中自旋方向相同的电子,彼此间是不可区分而且可以互相交换的,比如C的2px1电子与2py1电子在“运动”过程中可以互相交换,并且交换后无法区分彼此(区分这两个电子也是没有意义的一件工作)。在电子交换的过程中会放出能量,使原子体系获得一个额外的稳定性。自旋平行的一对电子失去一个时,交换能也随之消失。因此,电子在同一能级的简并轨道上以自旋平行方式排列比自旋相反排列的方式更稳定(因为自旋相反的两个电子不能交换,也就不会放出交换能使原子体系更稳定)。
显然地,p能级或d能级的最高的交换能出现在他们的半满结构,所谓半满结构是同一能级的所有轨道各自填充一个自旋平行的电子。能级达到半满结构时,以自旋平行方式存在的电子数目最大。导致的结果是半满结构是一种非常稳定的排布方式,如N原子的2p能级电子组态为2px12py12pz1,从这种排布移除一个电子时需要额外输入能量以克服这一最大的交换能(由于自旋相同的电子交换时释放能量,所以去掉一个平行自旋的电子时,体系就要吸收相应的能量)。Cr原子的电子组态为3d54s1而非3d44s2,就是因为前者的3d轨道达到半满结构,轨道具有最大的交换能(别忘记交换能指放出能量),从而使体系更稳定。p能级和d能级的全满结构也存在最大交换能(两组自旋方向相同的电子都达到最大数量),因此全满也有额外的稳定性。
显然地,s能级只有一个轨道,无论其半满还是全满,都不存在交换能,s能级的半满或全满结构都不会给原子体系带来额外的稳定性,因此谈论s能级的半满或全满态,对于稳定性的讨论是没有作用的。下面,我们详细地阐述Be的第一电离能高于B的原因。
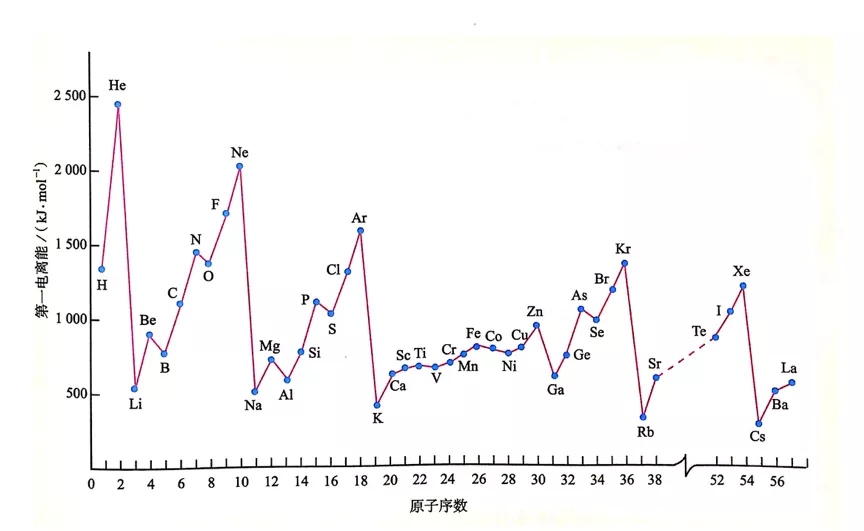
B的I1小于Be,从有效核电荷的角度,B(1s22s22p1)的2P电子受到的Zeff= 5−(0.85×2+0.35×2) = 2.6;Be(1s22s2)的2s电子受到的Zeff= 4−(0.85×2+0.35×1) = 1.95。Be的2s电子受到的核电荷的束缚虽然比B的2p电子的小,但是小得不多(达不到1个单位),加之2s轨道比2p轨道的钻穿效应强,屏蔽效应与钻穿效应的综合作用结果就导致了Be的2s电子比B的2p电子被整个原子体系束缚得更紧。这就充分地解释了B的I1小于Be的事实。高中教材(人教版)关于此解释为:B失去的是2p能级的电子,其能量高于Be的2s能级电子(如下图)。这实际上表达的是有效核电荷和钻穿效应的总结果。


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。为什么元素周期表第8族不归到主族或副族中?是为了与7个主族对应,列了7个副族.另外,第...
副族和Ⅷ族有什么区别? 是的,旧版教材Ⅷ族不属于副族: 2004年初审通过:人教版《高...
...
1895年首先由德国物理学家伦琴所发现。这种射线是不可见的,但能使底片感光。由于当时...
在科学昌盛的20世纪,利用人工方法把一种化学元素转变为另一种元素并不是不可能的。这...
以ⅢB族镧为首的一系列元素叫镧系元素。它包括从原子序数57到71共15种元素。这15种元...